题目内容
【题目】碘在科研与生活中有重要作用,某兴趣小组用0.50molL-1 KI、0.2%淀粉溶液、0.20molL-1 K2S2O8、0.10molL-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢) I2+2S2O32-=2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx= mL,理由是 。
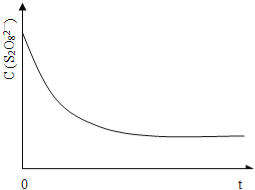
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注)。
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:2Li(s)+I2(s)=2LiI(s) △H
已知:4Li(s)+O2(g)=2Li2O(s) △H1
4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
则电池反应的△H= ;碘电极作为该电池的 极。
【答案】(1)Na2S2O3;<2(2)2;理由是保证其他条件不变,只改变反应物K2S2O8浓度,从而才到达对照实验目的(3)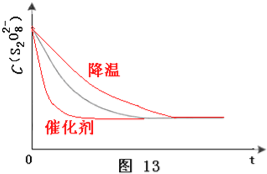 (4)
(4)![]() ;正极
;正极
【解析】
(1)根据KI、Na2S2O3与淀粉的反应原理解答,注意反应过程的快慢问题;
(2)根据实验目的及表格数据分析,从而确定Vx的大小及理由,注意探究物质的量浓度对反应速率影响时,其它条件应相同;
(3)降低温度,化学反应速率减小,则到达平衡时间延长;加入催化剂,增大反应速率,则缩短反应到达平衡时间;
(4)将第一个方程式与第二个方程式相减再除以2,焓变进行相应改变,正极上得电子发生还原反应.
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,先发生S2O82-+2I-═2SO42-+I2(慢),后发生I2+2S2O32-═S4O62-+2I-(快),当S2O32﹣耗尽后,碘才能与淀粉作用显示蓝色,根据I2+2S2O32-═S4O62-+2I-(快)方程式知,I2与S2O32﹣的物质的量的关系为1:2,即1mol碘需2mol S2O32-,根据方程式S2O82-+2I-═2SO42-+I2知,生成1mol碘需为1mol S2O82﹣,即n(S2O32-):n(S2O82-)=2:1,为确保能观察到蓝色,碘需有剩余,即n(S2O32-):n(S2O82﹣)<2;
(1)对照实验1和2发现,实验2取的0.20molL-1 K2S2O8溶液的体积9mL,比实验1少了1mL,说明取的K2S2O8物质的量少,加水1mL,保证了溶液的体积不变,所以在其它条件不变的情况下,探究的是该反应速率与K2S2O8浓度的关系,同样原理对照实验1和3,为保证溶液的体积相同,须加2mL水;
(1)保持其它条件不变,降低温度,反应速率降低,到达液颜色将由无色变成为蓝色的时间变长,而使用催化剂,能加快化学反应速率,所以到达液颜色将由无色变成为蓝色的时间变短,故答案为
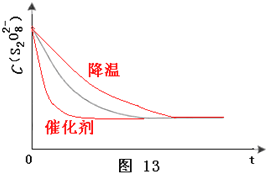 ;
;
(1)①4Li(s)+O2(g)=2Li2O(s) △H1
②4LiI(s)+O2(g)=2I2(s)+2Li2O(s) △H2
将方程式![]() 得2Li(s)+I2(s)=2LiI(s),△H=
得2Li(s)+I2(s)=2LiI(s),△H=![]() ,该反应中碘得电子发生还原反应,所以碘是在正极上发生反应,故答案为
,该反应中碘得电子发生还原反应,所以碘是在正极上发生反应,故答案为![]() ;正极。
;正极。

【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%