题目内容
【题目】研究SO2的转化对环境保护具有重要意义。
(1)一种将SO2转化为H2SO4和S的反应为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH
已知SO3(g)+H2O(g)=H2SO4(l) ΔH1=-177 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH2=-297 kJ·mol-1
2SO2(g)+O2(g)=2SO3(g) ΔH3=-197 kJ·mol-1 则ΔH=__________kJ·mol-1。
(2)SO2碱吸收液含NaHSO3和Na2SO3,NaHSO3可用于制取焦亚硫酸钠(Na2S2O5)。一种用SO2碱吸收液和三室膜电解技术制取NaHSO3的装置如图甲所示。已知常温下含硫微粒的物质的量分数如图乙所示,H2SO3的电离平衡常数K1=1.23×10-2、K2=5.6×10-8。

①电解后__________(填“a”、“b”或“c”)室的NaHSO3浓度较大。
②常温下,当SO2碱吸收液的pH=8时,溶液中c(SO32-)∶c(HSO3-)=__________。
③常温下0.1 mol·L-1 NaHSO3溶液中H2SO3、HSO3-、SO32-的物质的量浓度由大到小的顺序是__________。
(3)利用间接电化学法消除NO的原理如图丙所示。
①阴极的电极反应式为__________;
②吸收池每吸收转化1mol NO,阳极区生成标准状况下O2的体积为__________L。
【答案】-254 b 5.6(或28∶5) HSO3-、SO32-、H2SO3 2HSO3-+2e-+2H+=S2O42-+2H2O 28
【解析】
(1)根据盖斯定律书写出正确的方程式,并计算ΔH;
(2)①电解池阳极为稀硫酸溶液,电解质溶液显酸性,电解池阳极发生氧化反应,阳离子向阴极移动,据此分析;
②根据K2= =5.6×10-8及pH=8时c(H+)=10-8mol/L进行计算;
=5.6×10-8及pH=8时c(H+)=10-8mol/L进行计算;
③由图象可知,0.1 molL-1的NaHSO3溶液pH=4呈酸性,亚硫酸氢根离子电离程度大于水解程度;
(3)①阴极发生还原反应,HSO3-被还原为S2O42-,据此书写电极反应;
②电解池的阳极水电离出的OH-放电生成氧气,电极反应为:2H2O-4e-=4H++O2↑,吸收池中NO发生氧化还原反应生成NH4+,有NO~NH4+~5e-,根据电子守恒进行计算。
(1)①SO3(g)+H2O(g)=H2SO4(l) ΔH1=-177 kJ·mol-1;②S(s)+O2(g)=SO2(g) ΔH2=-297 kJ·mol-1;③2SO2(g)+O2(g)=2SO3(g) ΔH3=-197 kJ·mol-1;由盖斯定律可知2①-②+③得反应3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),ΔH=2×(-177 kJ·mol-1)-( -297 kJ·mol-1)+( -197 kJ·mol-1)=-254 kJ·mol-1;
(2)①电解池阳极为稀硫酸溶液,电解质溶液显酸性,电解池阳极发生氧化反应,阳离子向阴极移动,即H+向右侧移动,在b室发生反应:2H++2e-=H2↑ ,所以b室较a室H+浓度升高,因此电解后,b室的NaHSO3浓度增加;
②根据K2= 可知,
可知,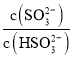 =
=![]() =
=![]() =5.6(或
=5.6(或![]() );
);
③由图象可知,0.1 molL-1的NaHSO3溶液pH=4呈酸性,亚硫酸氢根离子电离程度大于水解程度,因此溶液中H2SO3、HSO3-、SO32-的物质的量浓度由大到小的顺序为c(HSO3-)>c(SO32-)>c(H2SO3);
(3)①阴极发生还原反应,HSO3-被还原为S2O42-,电极反应为:2HSO3-+2e-+2H+=S2O42-+2H2O;
②电解池的阳极水电离出的OH-放电生成氧气,电极反应为:2H2O-4e-=4H++O2↑,吸收池中NO发生氧化还原反应生成NH4+,有NO~NH4+~5e-,当吸收转化1mol NO时,电子转移5mol,根据电子守恒可知当电子转移5mol时,生成氧气的物质的量为![]() =1.25mol,生成氧气的体积为22.4L/mol×1.25mol=28L。
=1.25mol,生成氧气的体积为22.4L/mol×1.25mol=28L。

【题目】将0.8 mol I2(g)和1.2 mol H2(g)置于某1L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) ![]() 2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
2HI(g) ΔH <0并达到平衡。HI的体积分数随时间的变化如表格所示:
HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
下列说法中正确的是
A. 在条件I下,该反应的平衡常数K=10
B. 在条件I下,从开始反应至5min,用H2表示的反应速率为0.10 mol/(L·min)
C. 在条件II下,到达平衡时, I2(g)的转化率为81.25%
D. 与条件I相比,为达到条件II的数据,可能改变的条件是降低压强