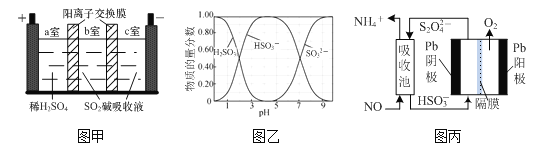
题目内容
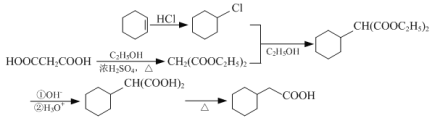
【题目】化合物E是合成农药茚虫威的中间体,其合成路线如下:

(1)写出A→B反应时还需的反应物及条件:__________。
(2)写出化合物D的结构简式:__________。
(3)写出一种符合下列条件的化合物E的同分异构体的结构简式:__________。
Ⅰ.既能发生银镜反应,也能与FeCl3溶液发生显色反应;
Ⅱ.含一个手性碳原子,核磁共振氢谱上有5种峰。
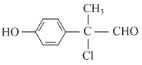
(4)根据已有知识并结合相关信息,写出以![]() 、HOOCCH2COOH、乙醇为原料制备
、HOOCCH2COOH、乙醇为原料制备![]() 的的合成路线流程图________________(无机试剂任用)。
的的合成路线流程图________________(无机试剂任用)。
【答案】Cl2、光照 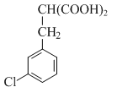
【解析】
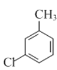 (A)与氯气在光照的条件下反应生成
(A)与氯气在光照的条件下反应生成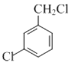 (B),
(B), 与CH2(COOC2H5)2与C2H5OH反应,生成
与CH2(COOC2H5)2与C2H5OH反应,生成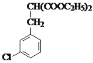 (C),
(C), 在OH-和H3O+条件下反应生成D,D的分子式为C10H9O4Cl,因此D的结构为
在OH-和H3O+条件下反应生成D,D的分子式为C10H9O4Cl,因此D的结构为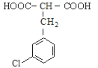 ,加热后生成
,加热后生成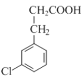 (E),据此分析解答。
(E),据此分析解答。
(1) (A)与氯气在光照的条件下反应生成
(A)与氯气在光照的条件下反应生成 (B),因此A→B反应时需要的反应物是氯气,条件是光照;
(B),因此A→B反应时需要的反应物是氯气,条件是光照;
(2)由分析可知化合物D的结构简式为 ,即
,即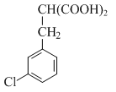 ;
;
(3)E的结构为 ,其同分异构体符合条件:Ⅰ.既能发生银镜反应,也能与FeCl3溶液发生显色反应,说明结构中含有醛基、含有酚羟基;Ⅱ.含一个手性碳原子,核磁共振氢谱上有5种峰,说明有1个碳原子上同时连接4个不同的原子或原子团,且有5个不同的氢原子,符合条件的有机物为
,其同分异构体符合条件:Ⅰ.既能发生银镜反应,也能与FeCl3溶液发生显色反应,说明结构中含有醛基、含有酚羟基;Ⅱ.含一个手性碳原子,核磁共振氢谱上有5种峰,说明有1个碳原子上同时连接4个不同的原子或原子团,且有5个不同的氢原子,符合条件的有机物为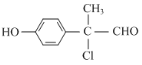 或
或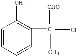 或
或 ;
;
(4)![]() 与HCl加成生成
与HCl加成生成![]() ,HOOCCH2COOH与C2H5OH在浓硫酸催化下反应生成CH2(COOC2H5)2,
,HOOCCH2COOH与C2H5OH在浓硫酸催化下反应生成CH2(COOC2H5)2,![]() 与CH2(COOC2H5)2反应生成
与CH2(COOC2H5)2反应生成![]() ,在OH-和H3O+条件下反应生成
,在OH-和H3O+条件下反应生成 ,加热后生成
,加热后生成![]() ,合成路线流程图为:
,合成路线流程图为: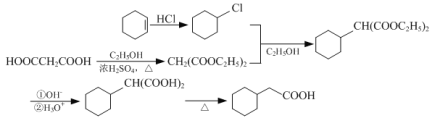 。
。

【题目】下列实验能达到目的的是( )
选项 | 目的 | 实验 |
A | 检验某品牌食盐是否为加碘盐 | 将样品溶解后滴加淀粉溶液 |
B | 检验补铁剂硫酸亚铁片是否部分氧化 | 取样品溶解于水,滴加铁氰化钾溶液 |
C | 鉴别葡萄糖溶液和蔗糖溶液 | 分别取样,滴加银氨溶液,水浴加热 |
D | 证明 | 将 |
A. AB. BC. CD. D
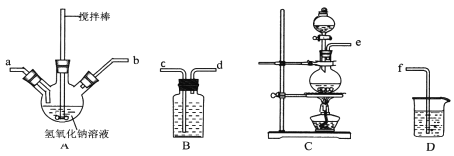
【题目】无水![]() 是一种重要的化工原料。某课外探究小组尝试制取无水
是一种重要的化工原料。某课外探究小组尝试制取无水![]() ,查阅资料获得下列信息:无水
,查阅资料获得下列信息:无水![]() 在
在![]() 升华,极易潮解,遇到水蒸气会产生白色烟雾。
升华,极易潮解,遇到水蒸气会产生白色烟雾。
探究一无水![]() 的实验室制备
的实验室制备
利用如图装置,用干燥、纯净的氯气在加热条件下与铝粉![]() 已除去氧化膜
已除去氧化膜![]() 反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液
反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液
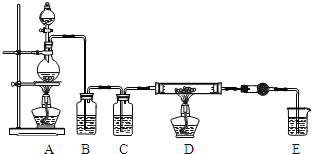
(1)写出装置A烧瓶中发生的反应方程式 ______ 。
(2)实验开始前,先检查装置气密性,然后装入药品,接下来的步骤依次是 ______ ![]() 填序号
填序号![]() 。
。
![]() 加热D中硬质玻璃管
加热D中硬质玻璃管
![]() 往A烧瓶中加入液体
往A烧瓶中加入液体
![]() 点燃A中的酒精灯
点燃A中的酒精灯
(3)上述供选药品中本实验无需用到的是 ______ ![]() 填数字序号
填数字序号![]() 。
。
(4)写出无水![]() 与水蒸气反应的化学方程式 ______ 。
与水蒸气反应的化学方程式 ______ 。
探究二无水![]() 的含量测定及结果分析
的含量测定及结果分析
取D中反应后所得固体![]() ,与足量氢氧化钠溶液反应,测定生成气体的体积
,与足量氢氧化钠溶液反应,测定生成气体的体积![]() 体积均换算成标准状况
体积均换算成标准状况![]() ,重复测定三次,数据如下:
,重复测定三次,数据如下:
第一次实验 | 第二次实验 | 第三次实验 | |
D中固体用量 |
|
|
|
氢气的体积 |
|
|
|
(5)根据表中数据,计算所得固体中无水![]() 的质量分数 ______ 。
的质量分数 ______ 。
(6)有同学认为测得的无水![]() 的质量分数偏低,你认为可能的原因有 ______ 。
的质量分数偏低,你认为可能的原因有 ______ 。
探究三离子浓度对氯气制备的影响
二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应停止不再产生氯气。探究小组对盐酸浓度降低影响氯气生成的原因进行如下探究:
(7)提出假设假设1:![]() 浓度降低影响氯气的生成
浓度降低影响氯气的生成
假设2: ______ 。
(8)设计方案进行实验。限选试剂:浓![]() 、NaCl固体、
、NaCl固体、![]() 固体、稀盐酸。
固体、稀盐酸。
步骤 | 实验操作 | 预测现象和结论 |
| 往不再产生氯气的装置中,加入 ______ ,继续加热 | 若有黄绿色气体生成,则假设1成立 |
| ______ | 若有黄绿色气体生成,则假设2成立 |