题目内容
7.配合物K3[Co(CN)6]中的中心离子是Co3+,配位体是CN-;在配合物[Co(NH3)5Cl]Cl2中,配位数数值是6.分析 根据配合物的结构特点可知,含有空轨道的金属阳离子为中心离子,含有孤电子对的分子或离子是配体,中心离子周围配体的数目即为配位数,根据配合物K3[Co(CN)6]结构分析可知,其中心离子为Co3+、配体为CN-、配位数为6,根据配合物[Co(NH3)5Cl]Cl2结构分析可知,其中心离子为Co3+、配体为Cl-、NH3,配位数为6,据此答题.
解答 解:根据配合物K3[Co(CN)6]结构分析,含有空轨道的金属阳离子为中心离子,所以中心离子为Co3+、有孤对电子的原子或离子为配体,所以配体为CN-、配位数就是配体的个数,所以配位数为6,在配合物[Co(NH3)5Cl]Cl2中,中心离子为Co3+、配体为Cl-、NH3,所以配位数为6,
故答案为:Co3+;CN-;6.
点评 本题考查配合物的结构,侧重于配合物组成的分析,题目难度不大.

练习册系列答案
 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目
13.关于对用惰性电极电解CuCl2溶液过程中的现象及本质的分析中正确的是( )
| A. | 所用电源可以直流电也可以是交流电 | |
| B. | 电解池工作过程中,阴离子移向阴极,阳离子移向阳极区 | |
| C. | 阳极区产生的气体可使湿润的KI-淀粉试纸变蓝色 | |
| D. | 若不考虑产物Cl2溶解产生的影响,则电解过程中溶液的浓度保持不变. |
2.下列除去杂质的方法正确的是( )
| A. | 除去N2 中少量的O2:通过灼热的CuO 粉末,收集气体 | |
| B. | 除去CO2 中的少量HCl:通入NaOH 溶液,收集气体 | |
| C. | 除去CaCl2 溶液中混有少量的盐酸,可加入过量的CaCO3,充分反应后过滤 | |
| D. | 除去KCl 溶液中的少量MgCl2:加入适量NaOH 溶液,过滤 |
12.在一定温度下,向不同电解质溶液中加入新物质时,其电流强度(I)随新物质加入量(m)的变化曲线不正确的是( )
| A. | 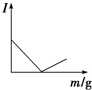 向Ba(OH)2溶液中逐滴加入等浓度的H2SO4至过量 | |
| B. | 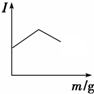 向醋酸溶液中逐滴加入等浓度的氨水至过量 | |
| C. | 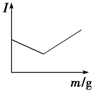 向盐酸溶液中逐滴加入等浓度的NaOH溶液至过量 | |
| D. | 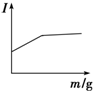 向氨水中逐滴加入等浓度的盐酸至过量 |
19.区分氯化铁溶液和氢氧化铁胶体的实验方法是( )
| A. | 布朗运动 | B. | 电泳 | C. | 胶体聚沉 | D. | 丁达尔效应 |
16.下列有关能量的判断或表示方法正确的是( )
| A. | 从C(石墨)=C(金刚石)△H=+1.9 kJ•mol-1,可知金刚石比石墨更稳定 | |
| B. | 相同条件下,等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量更多 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,可知:含1 molCH3COOH的溶液与含1 molNaOH的溶液混合,放出热量等于57.3 kJ | |
| D. | 2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2 H2O(l)△H=-285.8 kJ•mol-1 |
17.燃料电池是燃料(如CO、H2、CH4)等跟O2(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱(如KOH)溶液,下列关于甲烷燃料电池的说法中不正确的是( )
| A. | 通入氧气的一极发生还原反应,通入甲烷的一极发生氧化反应 | |
| B. | 负极的电极反应式为CH4+10OH--8e-═CO${\;}_{3}^{2-}$+7H2O | |
| C. | 随着反应的进行,电解质溶液的pH保持不变 | |
| D. | 甲烷燃料电池的能量利用率比甲烷燃烧的大 |
 .
.