题目内容
19.区分氯化铁溶液和氢氧化铁胶体的实验方法是( )| A. | 布朗运动 | B. | 电泳 | C. | 胶体聚沉 | D. | 丁达尔效应 |
分析 氢氧化铁胶体具有丁达尔效应,而氯化铁溶液不具备该性质,以此解答.
解答 解:胶体和溶液的区别是:氯化铁胶体具有丁达尔效应,而氯化铁溶液不具备,可以据此来鉴别二者.
故选D.
点评 本题考查胶体的特性以及溶液和胶体的鉴别知识,为高频考点,注意把握胶体的性质,难度不大.

练习册系列答案
相关题目
9. 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42-被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质.同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=11.50的溶液.
(2)高铁酸钾有以下几种常见制备方法:
①干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为3:1.
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O.
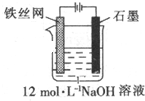
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为Zn,正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-.
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L,含有2.0×l0-4 mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为2.27×10-2mol.
 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.
高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性.(1)已知:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2↑.K2FeO4在处理水的过程中所起的作用有K2FeO4具有强氧化性,能够消毒杀菌;同时FeO42-被还原成Fe3+,Fe3+水解形成Fe(OH)3胶体,能够吸附水中悬浮杂质.同浓度的高铁酸钾在pH为4.74、7.00、11.50的水溶液中最稳定的是pH=11.50的溶液.
(2)高铁酸钾有以下几种常见制备方法:
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 电解法 | 制备中间产物NaFeO,再与KOH溶液反应 |
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:2FeO42-+Fe3++8OH-=3FeO43-+4H2O.
③制备中间产物Na2FeO4,可采用的装置如图所示,则阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
(3)比亚迪双模电动汽车使用高铁电池供电,其总反应为:
3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH
放电时负极材料为Zn,正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH-.
(4)25℃时,CaFeO4的Ksp=4.54×l0-9,若要使1000L,含有2.0×l0-4 mol•L-lK2FeO4的废水中的c(FeO42-)有沉淀产生,理论上至少加入Ca(OH)2的物质的量为2.27×10-2mol.
10.已知反应X(g)+Y(g)═nZ(g)△H<0,将X和Y以一定比例混合通入2L密闭容器中进行反应,各物质的物质的量随时间的改变如图.下列说法正确的是( )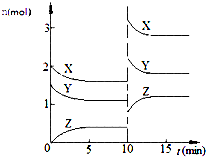

| A. | 反应方程式中n=2 | |
| B. | 该反应的△S>0 | |
| C. | 10 min时,曲线发生变化的原因是增大压强 | |
| D. | 0~5min内,平均反应速率v(X)=0.04 mol•L-1•min-1 |
14.下列说法正确的是( )
| A. | 用30%的H2O2消除面部色斑 | |
| B. | 当不慎在皮肤上沾上少量的浓H2SO4时,应立即用大量水冲洗,并涂上2%的NaHCO3溶液 | |
| C. | 试样$\stackrel{BaCl_{2}}{→}$ 白色沉淀$\stackrel{HCl}{→}$白色沉淀不溶解,则试样中一定有SO42- | |
| D. | 不慎将浓盐酸洒在桌上,应立即用浓NaOH溶液冲洗 |
4.0.3mol的RxO42-被氧化为RO2时失去0.6mol电子,则x为( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
11.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4 L H2O含有的分子数为NA | |
| B. | 2.7g铝与足量氢氧化钠溶液反应转移的电子数NA | |
| C. | 0.5 mol/L Fe2(SO4)3溶液中,SO42-的数目为1.5NA | |
| D. | 常温常压下,48 g O2和O3 的混合物中含有的氧原子数为3NA |
8.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,其中正确的操作顺序是①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥蒸发结晶( )
| A. | ②⑤④③①⑥ | B. | ④①②⑤③⑥ | C. | ④②①③⑤⑥ | D. | ⑤②④①③⑥ |

 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N在周期表的位置是同一周期从左到右,N 的原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N在周期表的位置是同一周期从左到右,N 的原子半径更小,原子核对外层电子的吸引力更强.