题目内容
【题目】我国科学家合成铬的化合物通过烷基铝和[ph3C]+[B(C6F5)4]-活化后,对乙烯聚合表现出较好的催化活性。合成铬的化合物过程中的一步反应为:
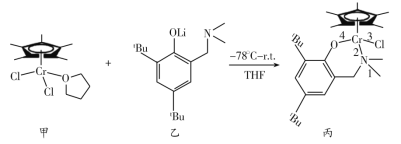
回答下列问题:
(1)Cr3+具有较强的稳定性,Cr3+核外电子排布式为___;已知没有未成对d电子的过渡金属离子的水合离子是无色的,Ti4+、V3+、Ni2+、Cu+四种离子的水合离子为无色的是___(填离子符号)。
(2)化合物丙中1、2、3、4处的化学键是配位键的是___处,聚乙烯链中碳原子采取的杂化方式为___。
(3)无水CrCl3与NH3作用可形成化学式为CrCl3·5NH3的配位化合物。向该配位化合物的水溶液中加入AgNO3溶液,CrCl3·5NH3中的氯元素仅有![]() 沉淀为AgC1;向另一份该配位化合物的水溶液中加入足量NaOH浓溶液,加热并用湿润红色石蕊试纸检验时,试纸未变色。该配位化合物的结构简式为___。
沉淀为AgC1;向另一份该配位化合物的水溶液中加入足量NaOH浓溶液,加热并用湿润红色石蕊试纸检验时,试纸未变色。该配位化合物的结构简式为___。
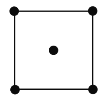
(4)水在合成铬的化合物的过程中作溶剂。研究表明水能凝结成13种类型的结晶体。重冰(密度比水大)属于立方晶系,其立方晶胞沿x、y或z轴的投影图如图所示,晶体中H2O的配位数为__,晶胞边长为333.7pm,则重冰的密度为__g·cm-3(写出数学表达式,NA为阿伏加德罗常数)。
【答案】1s22s22p63s23p63d3 Ti4+、Cu+ 2 sp3 [Cr(NH3)5C1]Cl2 8 ![]() ×1030
×1030
【解析】
(1)Cr原子核外电子数为24,核外电子排布为1s22s22p63s23p63d54s1,原子失去4s能级1个电子、3d能级2个电子形成Cr3+,Cr3+电子排布式为:1s22s22p63s23p63d3;
Ti4+的核外电子排布为1s22s22p63s23p6,无未成对电子,其水溶液为无色;
V3+的核外电子排布为1s2 2s22p63s23p63d2,3d轨道有两个未成对电子,其水溶液有颜色;
Ni2+的核外电子排布式为1s22s22p63s23p63d8,3d轨道有2个未成对电子,其水溶液有颜色;
Cu+的核外电子排布式为1s22s22p63s23p63d10,无未成对电子,其水溶液为无色;
综上所述水合离子为无色的是Ti4+、Cu+;
(2)O可以形成两个共价键,Cl可以形成1个共价键,N可以形成3个共价键,丙中N原子形成4条化学键,则其中一条为配位键,形成配位键时一般由非金属元素提供孤对电子,金属阳离子提供空轨道,所以2应为配位键;聚乙烯中碳原子形成4条单键,应为sp3杂化;
(3)向该配位化合物的水溶液中加入AgNO3溶液,CrCl3·5NH3中的氯元素仅有![]() 沉淀为AgC1,说明该配合物可以电离出两个Cl-,说明两个Cl-为该配合物的外界;向另一份该配位化合物的水溶液中加入足量NaOH浓溶液,加热并用湿润红色石蕊试纸检验时,试纸未变色说明NH3均位于内界,结合电荷守恒可知该配合物应为[Cr(NH3)5C1]Cl2;
沉淀为AgC1,说明该配合物可以电离出两个Cl-,说明两个Cl-为该配合物的外界;向另一份该配位化合物的水溶液中加入足量NaOH浓溶液,加热并用湿润红色石蕊试纸检验时,试纸未变色说明NH3均位于内界,结合电荷守恒可知该配合物应为[Cr(NH3)5C1]Cl2;
(4)根据立方晶胞沿x、y或z轴的投影可知,该晶体为体心立方堆积,所以晶体中H2O的配位数为8;晶胞中H2O的分子个数为![]() =2,则晶胞的质量m=
=2,则晶胞的质量m=![]() ,晶胞边长为333.7pm,即333.7×10-10cm,则晶胞体积V=(333.7×10-10)3cm3,所以晶胞的密度
,晶胞边长为333.7pm,即333.7×10-10cm,则晶胞体积V=(333.7×10-10)3cm3,所以晶胞的密度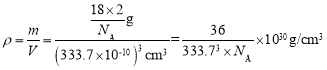 。
。

 期末集结号系列答案
期末集结号系列答案【题目】根据下列实验或实验操作和现象,所得结论正确的是
实验或实验操作 | 现象 | 实验结论 | |
A | 用大理石和盐酸反应制取CO2气体,立即通入一定浓度的Na2SiO3溶液中 | 出现白色沉淀 | H2CO3的酸性比H2SiO3的酸性强 |
B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
C | 将纯Zn片与纯Cu片用导线连接,浸入到稀硫酸溶液中 | Cu片表面产生大量气泡 | 金属性:Zn>Cu |
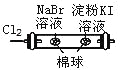
D |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
A. A B. B C. C D. D
【题目】自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展。
(1)下表列举了不同温度下大气固氮的部分平衡常数K值。
反应 | 大气固氮N2(g)+O2(g) | |
温度/℃ | 27 | 2260 |
K | 3.84×10-31 | 1 |
①分析数据可知:大气固氮反应属于______(填“吸热”或“放热”)反应。
②2260℃时,向2 L密闭容器中充入0.3mol N2和0.3mol O2,20 s时反应达平衡。则此 时得到NO____mol,用N2表示的平均反应速率为____。
(2)已知工业固氮反应:N2(g)+3H2(g) ![]() 2NH3 (g) △H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中 正确的是_____(填“A”或“B”),T1______T2(填“>”或“<”)。
2NH3 (g) △H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中 正确的是_____(填“A”或“B”),T1______T2(填“>”或“<”)。
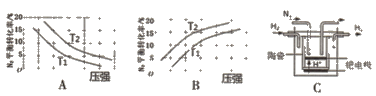
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它 内外表面上的金属钯多晶薄膜做电极,通过电解实现高温常压下的电化学合成氨。其示意图如C所示,阴极的电极反应式为______。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3 (aq) +3O2(g) △H。
4NH3 (aq) +3O2(g) △H。
已知:①N2(g)+3H2(g) ![]() 2NH3(g) △H1
2NH3(g) △H1
②2H2(g) +O2(g) ![]() 2H2O(1) △H2
2H2O(1) △H2
③NH3(g) ![]() NH3(aq) △H3
NH3(aq) △H3
则△H= ________(用含△H1、△H2、△H3的式子表示)。