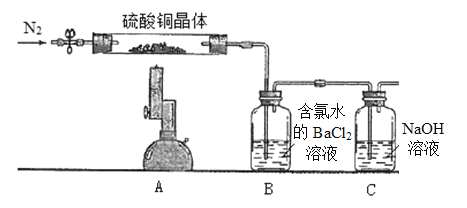
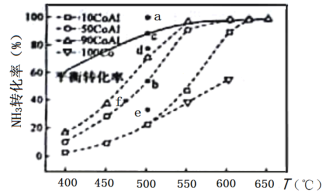
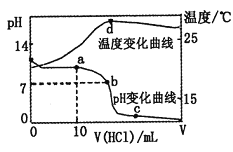
题目内容
【题目】化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示。下列有关叙述正确的是
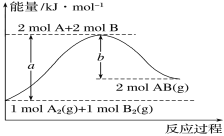
A.每生成2molAB(g)吸收bkJ热量
B.断裂1molA—A键和1molB—B键,放出akJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.反应热ΔH=+(a-b)kJ·mol-1
【答案】D
【解析】
化学反应A2(g)+B2(g)=2AB(g)的能量变化依据图象分析,结合反应前后能量守恒可知,反应物能量之和小于生成物的能量之和,反应是吸热反应,反应过程中断裂化学键需要吸收能量,形成化学键放出热量。
A、形成化学键放出热量,每生成2mol AB放出bkJ热量,故A错误;
B、断裂1molA-A键和1molB-B键,吸收a kJ能量,故B错误;
C、反应是吸热反应,依据能量守恒可知,反应中反应物的总能量低于生成物的总能量,故C错误;
D、该反应焓变=断裂化学键吸收热量-形成化学键所放出热量,所以焓变为△H=+(a-b)kJ·mol-1;故D正确;
故选D。

练习册系列答案
相关题目