题目内容
(1)二甲醛(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的新工艺主要发生三个反应:
①CO(g)+2H2(g)?CH3OH(g)△H1=-91kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-24kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H1=-41kJ?mol-1
新工艺的总反应为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)该反应△H=
(2)处理含CO、NO2废气污染的一种方法,是将其在催化剂作用下转化为单质N2.已知:
CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1
N2(g)+O2(g)═NO2(g)△H=-296.0kJ?mol-1
此反应的热化学方程式是 .
①CO(g)+2H2(g)?CH3OH(g)△H1=-91kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-24kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H1=-41kJ?mol-1
新工艺的总反应为:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)该反应△H=
(2)处理含CO、NO2废气污染的一种方法,是将其在催化剂作用下转化为单质N2.已知:
CO(g)+
| 1 |
| 2 |
| 1 |
| 2 |
此反应的热化学方程式是
分析:(1)根据盖斯定律计算化学反应的焓变△H;
(2)处理含CO、NO2废气污染的化学方程式为:4CO(g)+2NO2(g)═N2(g)+4CO2(g),根据盖斯定律来计算化学反应的焓变.
(2)处理含CO、NO2废气污染的化学方程式为:4CO(g)+2NO2(g)═N2(g)+4CO2(g),根据盖斯定律来计算化学反应的焓变.
解答:解:(1)已知①CO(g)+2H2(g)?CH3OH(g)△H1=-91kJ?mol-1,
②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-24kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ?mol-1,
根据盖斯定律,①×2+②+③得:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ?mol-1,
故答案为:-247kJ?mol-1;
(2)已知:①CO(g)+
O2(g)═CO2(g)△H=-283.0kJ?mol-1;
②
N2(g)+O2(g)═NO2(g)△H=-296.0kJ?mol-1,
将方程式①×4-②×2得:4CO(g)+2NO2(g)═N2(g)+4CO2(g),△H1=(-283.0kJ?mol-1)×4-(-296.0kJ?mol-1)×2=-540kJ?mol-1,
所以其热化学反应方程式为:4CO(g)+2NO2(g)═N2(g)+4CO2(g),△H=-540kJ?mol-1,
故答案为:4CO(g)+2NO2(g)═N2(g)+4CO2(g),△H=-540kJ?mol-1.
②2CH30H(g)?CH30CH3(g)+H20(g)△H2=-24kJ?mol-1,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ?mol-1,
根据盖斯定律,①×2+②+③得:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-247kJ?mol-1,
故答案为:-247kJ?mol-1;
(2)已知:①CO(g)+
| 1 |
| 2 |
②
| 1 |
| 2 |
将方程式①×4-②×2得:4CO(g)+2NO2(g)═N2(g)+4CO2(g),△H1=(-283.0kJ?mol-1)×4-(-296.0kJ?mol-1)×2=-540kJ?mol-1,
所以其热化学反应方程式为:4CO(g)+2NO2(g)═N2(g)+4CO2(g),△H=-540kJ?mol-1,
故答案为:4CO(g)+2NO2(g)═N2(g)+4CO2(g),△H=-540kJ?mol-1.
点评:本题考查学生盖斯定律来计算化学反应的焓变知识,是现在考试的热点,难度不大.

练习册系列答案
相关题目
 生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.
生物质资源是一种污染小的可再生能源.生物质的主要转化途径及主要产物如图.
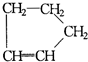 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:


 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是:
)b mol,则a和b的代数关系是: )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式 、
、 、
、 、
、
 .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A

 ,则推测得[A]的结构式为
,则推测得[A]的结构式为 
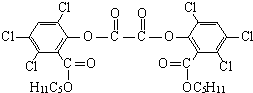 “魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯
“魔棒”常用于晚会气氛的渲染,其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后发光.草酸二酯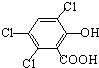 )在催化剂和适当条件下可以生成CPPO,则:
)在催化剂和适当条件下可以生成CPPO,则: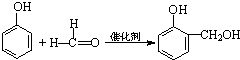 ,
,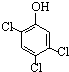 与(CH3)2C=CH2也可以发生类似的反应生成N,则N结构简式为
与(CH3)2C=CH2也可以发生类似的反应生成N,则N结构简式为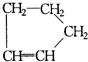

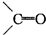
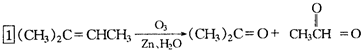
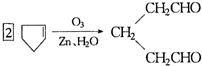
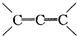

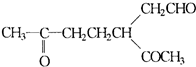
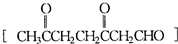
 是环戊烯的结构简式,可进一步简写为
是环戊烯的结构简式,可进一步简写为 ,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基(
,环烯烃的化学性质跟烯烃相似. ②有机化合物中的烯键可以跟臭氧(O3)反应,再在锌粉存在下水解即将原有的烯键断裂,断裂处两端的碳原子各结合1个氧原子而生成醛基(-CHO)或酮基( ),这两步反应合在一起,称为“烯键的臭氧分解”.例如:
),这两步反应合在一起,称为“烯键的臭氧分解”.例如:

 结构),发生臭氧分解后,测得有机产物中含有羰基(
结构),发生臭氧分解后,测得有机产物中含有羰基( )b mol,则a和b的代数关系是: 或 .
)b mol,则a和b的代数关系是: 或 . )和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式 .
)和乙醇为有机原料,合成己二酸二乙酯的各步反应方程式 . .A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A ,B .
.A经催化加氢后得产物B,B的化学式为C10H20,分析数据表明,B分子内含有六元碳环.试写出A和B的结构简式A ,B . ,则推测得[A]的结构式为
,则推测得[A]的结构式为