题目内容
【题目】实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如图1所示:


(1)如图2所示,过滤操作中的一处错误是___________。
(2)高温焙烧时,用于盛放固体的仪器名称是_____________。
(3)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

①装置B中盛放饱和NaCl溶液,该装置的主要作用是__________。
②F 中试剂是浓硫酸,若用一件仪器装填适当试剂后也可起到F和G的作用,则该仪器及所装填的试剂为_______。
③装置E的作用是__________。
④制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式____________。
【答案】漏斗下端尖嘴未紧贴烧杯内壁 坩埚 除去HCl 装有碱石灰的干燥管 收集氯化铝产品 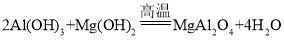
【解析】
(1)用过滤操作的“两低三靠”来分析;
(2)高温焙烧通常选用坩埚来盛放固体,注意坩埚有多种材质。
(3)除去氯气中的氯化氢气体,首选饱和食盐水;从F和G的作用上考虑替代试剂;从题给的流程上判断高温焙烧时的反应物和生成物并进行配平。
(1)漏斗下方尖端应当贴紧烧杯壁,以形成液体流,加快过滤速度;
(2)坩埚通常可用于固体的高温焙烧;
(3)①浓盐酸易挥发,用饱和食盐水可除去浓盐酸挥发出的HCl气体,并降低氯气的溶解损耗;
②F装置的作用是吸收水分,防止水分进入收集瓶,G装置的作用是吸收尾气中的氯气,防止污染环境。用装有碱石灰的球形干燥管可以同时实现上述两个功能;
③图中已标注E是收集瓶,其作用是收集D装置中生成的氯化铝;
④从整个流程图可以看出,用氨水从溶液中沉淀出Al(OH)3和Mg(OH)2,再通过高温焙烧来制取目标产物MgAl2O4,所以反应物为Al(OH)3和Mg(OH)2,生成物为MgAl2O4,该反应的化学方程式为: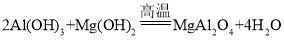
。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案【题目】下列对文中描述内容的相关解释正确的是( )
选项 | 描述 | 解铎 |
A | 丹砂烧之成水银,积变又还成丹砂 | 两个反应互为可逆反应 |
B | 凡埏泥造瓦,掘地二尺余,择取无沙粘土而为之 | 其中“瓦”的主要成分为硅酸盐 |
C | 硝石(KNO3)如握盐雪不冰,强烧之,紫青烟起 | 产生“紫青烟”的原因为KNO3分解 |
D | 其法用浓酒精和槽入瓶,蒸令气上,用器承滴露 | 其中涉及的操作方法为蒸发浓缩 |
A. AB. BC. CD. D


