题目内容
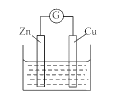
【题目】将反应 Cu(s)+2Ag+(aq) == Cu2+(aq)+2Ag(s)设计成如图所示原电池。下列说法中正确的是( )

A. 电极X是正极,其电极反应为Cu-2e-== Cu2+
B. 银电极板质量逐渐减小,Y溶液中c(Ag+)增大
C. 当X电极质量变化0.64 g时,Y溶液质量变化2.16 g
D. 外电路中电流由银极流向铜极
【答案】D
【解析】
A、电极X的材料是铜,为原电池的负极,其电极反应为Cu-2e-== Cu2+,错误;B、银电极为电池的正极,被还原,发生的电极反应为:Ag++ e--==Ag,银电极质量逐渐增大,Y溶液中c(Ag+)减小,错误;C、当X电极质量减少0.64 g时,即0.64g ÷64g/mol=0.01 mol,则正极有0.02 mol的银单质析出,即0.02mol×108 g/mol=2.16 g,则溶液质量变化应为2.16 g-0.64 g=1.52 g。错误;D、电极X的材料是铜,为原电池的负极;银电极为电池的正极,外电路中电流由正极(银电极)流向负极(铜电极)。正确;故选D。

【题目】氨气在工农业生产和国防科技中有着重要应用,科研工作者对其进行者广泛研究。回答:
(1)某课题组实现了在常湿常压下,以氮气和液态水为原料制备氨气同时有氧气生成。
已知,在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成热(△H)。常温常压下、相关物质的生成热如下表所示:
物质 | NH3(s) | H20(1) |
△H/ kJ·mo1-1 | -46 | -242 |
上述合成氨反应的热化学方程式为______________________。
(2)利用生物电池,以H2、N2为原料合成氨的装置如下图所示。

Q、R均为催化剂,据到示判断,负极反应的催化剂为___(填“Q”或“R”);正极的电极反应式为_______________。
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I.4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-906kJ/mol
4NO(g)+6H2O(g)△H=-906kJ/mol
II.4NH3(g)+3O2(g)![]() 2N2(g)+ 6H2O(g)△H=-126kJ/mol
2N2(g)+ 6H2O(g)△H=-126kJ/mol
将固定比例NH3和O2的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
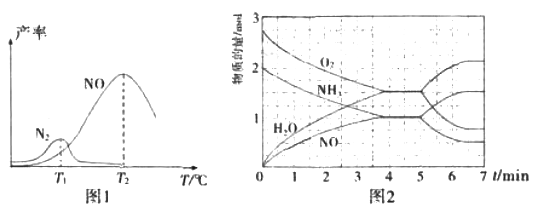
①催化氧化步骤中,最适宜的温度为____(填“T1”或“T2”)。
②低于T1℃时,NO的产率较低的原因为_____。
③高于T2℃时,NO的产率降低的可能原因为_____(填选项字母)
A.催化剂活性降低 B.平衡常数减小 C.反应活化能增大 D.氨气溶于水
④T2℃(T1>T2)时,向20L恒容密闭容器中充入2molNH3和2.75mo1O2,发生反应I.反应过程中各物质的物质的量的随时间(t)变化关系如图2所示。T2℃时,该反应的平衡常数K=_____;5min时,改变了某一外界条件,所改变的条件可能为__________。
【题目】某课外兴趣小组用下图装置探究条件对Na2S2O3溶液与稀H2SO4反应速率的影响。请回答有关问题。
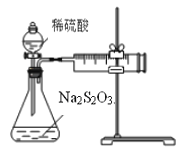
(1)写出该反应的离子方程式_______________________________________________________。
(2)连接好仪器后,开始实验前还需进行的操作是_____________________________________。
(3)现探究浓度对该反应速率(单位mL/min)的影响。
①应测定的实验数据为_____________。
②该实验实施过程中测定的气体体积比实际值偏小的一个重要原因是:____________________。
(4)若该小组同学设计了如下四组实验,
实验 | 反应温度 /℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | |||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | |||
A | 25 | 5 | 0.1 | 10 | 0.1 | 5 | |
B | 25 | 5 | 0.2 | 5 | 0.2 | 10 | |
C | 35 | 5 | 0.1 | 10 | 0.1 | 5 | |
D | 35 | 5 | 0.2 | 5 | 0.2 | 10 | |
① 实验数据体现了反应物__________(填化学式)的浓度及__________条件对反应速率的影响。
② 预测反应速率最快的一组实验序号为____________。