题目内容
配制500mL 0.25mol?L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将

(3)配制方法:某同学设计了四个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温.
②将NaOH溶液沿玻璃棒注入
③继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm.
④改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
若按上述步骤配制溶液物质的量浓度会
(1)计算:需要NaOH固体的质量为
5.0g
5.0g
.(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将
高于
高于
(填“高于”或“低于”)右边的托盘.欲使天平平衡,所进行的操作为将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡
将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡
.假定最终称得小烧杯的质量为32.6g
32.6g
(填“32.6g”或“31.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝 码过程) |
↓↑ ↓↑ |
↓ ↓ |
↓↑ ↓↑ |
↓ ↓ |
↓↑ ↓↑ |

(3)配制方法:某同学设计了四个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温.
②将NaOH溶液沿玻璃棒注入
500mL容量瓶
500mL容量瓶
中.③继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm.
④改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
若按上述步骤配制溶液物质的量浓度会
偏低
偏低
(填“偏高”“偏低”或“无影响”).若无影响下面不用填写,若有影响,应在步骤②
②
和步骤③
③
之间,补充的操作是在烧杯中加入少量的蒸馏水,小心洗涤2~3次,洗涤液也全部移入容量瓶
在烧杯中加入少量的蒸馏水,小心洗涤2~3次,洗涤液也全部移入容量瓶
.分析:(1)根据500mL 0.25mol?L-1的NaOH溶液中含有的氢氧化钠的物质的量计算出质量;
(2)根据天平的称量原理及正确使用方法完成;
(3)配制500mL一定物质的量难度的溶液需要使用500mL容量瓶;没有洗涤烧杯和玻璃棒,导致溶液中溶质的物质的量减小;应该在定容之前进行洗涤烧杯和玻璃棒,将洗涤的溶液转移到容量瓶中.
(2)根据天平的称量原理及正确使用方法完成;
(3)配制500mL一定物质的量难度的溶液需要使用500mL容量瓶;没有洗涤烧杯和玻璃棒,导致溶液中溶质的物质的量减小;应该在定容之前进行洗涤烧杯和玻璃棒,将洗涤的溶液转移到容量瓶中.
解答:解:(1)配制500mL 0.25mol?L-1的NaOH溶液,需要氢氧化钠的物质的量为:0.25mol?L-1×0.5L=0.125mol,质量为:40g/mol×0.125mol=5.0g,
故答案为:5.0g;
(2)天平静止时发现指针在分度盘的偏右位置,右盘较重,左盘会高于右盘;欲使天平平衡,将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡;托盘天平的准确度为0.1g,所以小烧杯的质量为32.6g;
用托盘天平准确称其质量,先在右盘加入50g砝码,质量过大,表示为:50g↓↑;然后换20g砝码,砝码质量不足,表示为:20g↓;再加20g砝码,20g砝码质量过大,表示为:↓↑;换10g砝码,10g砝码质量不足,表示为:10g↓;再加5g砝码,5g砝码质量过大,拿下5g砝码,表示为:5g↓↑;最后移动游码到2.6g进行调平天平,标尺上画出游码的位置为: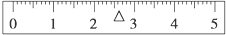 ,
,
故答案为:高于;将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡; 32.6g;
 ;
;
(3)②将NaOH溶液沿玻璃棒注入500mL容量瓶中;操作中没有洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量减小,溶液的浓度偏低;正确操作为:在定容之前进行洗涤烧杯和玻璃棒,即在②和③之间,并将洗涤液转移到容量瓶中,
故答案为:500mL容量瓶;偏低;②;③;在烧杯中加入少量的蒸馏水,小心洗涤2~3次,洗涤液也全部移入容量瓶.
故答案为:5.0g;
(2)天平静止时发现指针在分度盘的偏右位置,右盘较重,左盘会高于右盘;欲使天平平衡,将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡;托盘天平的准确度为0.1g,所以小烧杯的质量为32.6g;
用托盘天平准确称其质量,先在右盘加入50g砝码,质量过大,表示为:50g↓↑;然后换20g砝码,砝码质量不足,表示为:20g↓;再加20g砝码,20g砝码质量过大,表示为:↓↑;换10g砝码,10g砝码质量不足,表示为:10g↓;再加5g砝码,5g砝码质量过大,拿下5g砝码,表示为:5g↓↑;最后移动游码到2.6g进行调平天平,标尺上画出游码的位置为:
 ,
,故答案为:高于;将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡; 32.6g;
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) | ↓↑ | ↓ | ↓↑ | ↓ | ↓↑ |
 ;
;(3)②将NaOH溶液沿玻璃棒注入500mL容量瓶中;操作中没有洗涤烧杯和玻璃棒,导致配制的溶液中溶质的物质的量减小,溶液的浓度偏低;正确操作为:在定容之前进行洗涤烧杯和玻璃棒,即在②和③之间,并将洗涤液转移到容量瓶中,
故答案为:500mL容量瓶;偏低;②;③;在烧杯中加入少量的蒸馏水,小心洗涤2~3次,洗涤液也全部移入容量瓶.
点评:本题考查了配制一定物质的量浓度的步骤,题目难度不大,掌握配制基本步骤:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、贮存溶液,注意计算时要抓住溶质守恒.

练习册系列答案
相关题目
配制500mL 0.1mol?L-1的NaCl溶液,需用到的仪器是( )
| A、500mL容量瓶 | B、试管 | C、酒精灯 | D、分液漏斗 |
