题目内容
实验室常用的浓盐酸物质的量浓度约为12.0mol?L-1.
(1)实验室欲用上述浓盐酸配制500mL 0.20mol?L-1 的稀盐酸溶液,则需要取上述浓盐酸
a、10mL量筒 b、50mL量筒 c、100mL量筒
(2)配制过程中,不需要的仪器(填写代号)
A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯
除上述仪器外完成实验还缺少的玻璃仪器是
(3)在配制过程中,若其它操作均正确,下列操作会引起结果偏高的是
A.没有洗涤烧杯和玻璃棒 B.未等NaOH溶液冷却至室温就转移到容量瓶中
C.容量瓶不干燥,含有少量蒸馏水 D.定容时俯视容量瓶刻度线
(4)用8.7gMnO2氧化足量的上述12.0mol?L-1的浓盐酸.反应方程式如下:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
则:①用双线桥表示上述反应中电子转移的方向和数目
 ;
;
②产生的Cl2在标准状况下的体积为多少?(写出计算过程)
③有
(1)实验室欲用上述浓盐酸配制500mL 0.20mol?L-1 的稀盐酸溶液,则需要取上述浓盐酸
8.3
8.3
mL?进行这步操作时,应选择下列量器a
a
(填序号).a、10mL量筒 b、50mL量筒 c、100mL量筒
(2)配制过程中,不需要的仪器(填写代号)
A
A
.A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯
除上述仪器外完成实验还缺少的玻璃仪器是
500mL容量瓶
500mL容量瓶
.(3)在配制过程中,若其它操作均正确,下列操作会引起结果偏高的是
BD
BD
A.没有洗涤烧杯和玻璃棒 B.未等NaOH溶液冷却至室温就转移到容量瓶中
C.容量瓶不干燥,含有少量蒸馏水 D.定容时俯视容量瓶刻度线
(4)用8.7gMnO2氧化足量的上述12.0mol?L-1的浓盐酸.反应方程式如下:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
则:①用双线桥表示上述反应中电子转移的方向和数目


②产生的Cl2在标准状况下的体积为多少?(写出计算过程)
③有
0.2
0.2
摩尔HCl被氧化?分析:(1)根据稀释定律c1V1=c2V2,稀释前后溶质HCl的物质的量不变,据此计算需要浓盐酸的体积;
根据浓盐酸的体积选择量筒的规格;
(2)根据溶液的配制步骤选择所使用的仪器,判断不需要的仪器与缺少的仪器;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=
分析操作对所配溶液浓度的影响;
(4)①根据Mn、Cl元素的化合价变化来分析,化合价升高的元素原子失去电子,化合价降低的元素的原子得到电子,化合价升高值=化合价降低值=转移电子数;
②令标准状况生成氯气的体积为V,根据方程式进行计算;
③被氧化的HCl中Cl元素生成氯气,根据氯原子守恒,计算被氧化的HCl.
根据浓盐酸的体积选择量筒的规格;
(2)根据溶液的配制步骤选择所使用的仪器,判断不需要的仪器与缺少的仪器;
(3)分析操作对溶质物质的量、溶液体积的影响,根据c=
| n |
| V |
(4)①根据Mn、Cl元素的化合价变化来分析,化合价升高的元素原子失去电子,化合价降低的元素的原子得到电子,化合价升高值=化合价降低值=转移电子数;
②令标准状况生成氯气的体积为V,根据方程式进行计算;
③被氧化的HCl中Cl元素生成氯气,根据氯原子守恒,计算被氧化的HCl.
解答:解:(1)根据稀释定律,稀释前后溶质HCl的物质的量不变,令需要浓盐酸的体积为V,则:V×12.0mol?L-1=500mL×0.20mol?L-1,解得V≈8.3mL,故应选择10mL量筒;
故答案为:8.3;a;
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀,所需要的仪器有:玻璃棒、10mL量筒、胶头滴管、烧杯、500mL容量瓶,
故不需要的仪器为:A.药匙;
还缺少的玻璃仪器是:500mL容量瓶;
故答案为:A;500mL容量瓶;
(3)A.烧杯与玻璃棒上沾有少量HCl,没有洗涤烧杯和玻璃棒,移入容量瓶内HCl的物质的量减小,所配溶液的浓度偏低,故A不符合;
B.未等NaOH溶液冷却至室温就转移到容量瓶中进行定容,冷却后溶液的体积偏小,所配溶液的浓度偏高,故B符合;
C.溶液配制需加水定容,容量瓶不干燥,含有少量蒸馏水,对所配溶液浓度无影响,故C不符合;
D.定容时俯视容量瓶刻度线,溶液凹液面在刻度线以下,导致所配溶液体积偏小,所配溶液浓度偏高,故D符合;
故选BD;
(4)①反应MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O中,Mn元素的化合价由+4降低为+2价,Cl元素的化合价由-1升高为0价,转移的电子数为:2e-,则双线桥法标出电子得失的方向和数目为: ;
;
故答案为: ;
;
②令标准状况生成氯气的体积为V,则:
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
87g 22.4L
8.7g V
所以:87g:8.7g=22.4L:V
解得:V=2.24L
答:标准状况生成氯气的体积为2.24L;
③标准状况下2.24L氯气的物质的量为
=0.1mol,被氧化的HCl中Cl元素生成氯气,根据氯原子守恒,被氧化的HCl物质的量为:0.1mol×2=0.2mol;
故答案为:0.2.
故答案为:8.3;a;
(2)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,用10mL量筒量取(用到胶头滴管)浓盐酸,在烧杯中稀释,并用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯与玻璃棒2~3次,并移入容量瓶内,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,盖好瓶塞,反复颠倒摇匀,所需要的仪器有:玻璃棒、10mL量筒、胶头滴管、烧杯、500mL容量瓶,
故不需要的仪器为:A.药匙;
还缺少的玻璃仪器是:500mL容量瓶;
故答案为:A;500mL容量瓶;
(3)A.烧杯与玻璃棒上沾有少量HCl,没有洗涤烧杯和玻璃棒,移入容量瓶内HCl的物质的量减小,所配溶液的浓度偏低,故A不符合;
B.未等NaOH溶液冷却至室温就转移到容量瓶中进行定容,冷却后溶液的体积偏小,所配溶液的浓度偏高,故B符合;
C.溶液配制需加水定容,容量瓶不干燥,含有少量蒸馏水,对所配溶液浓度无影响,故C不符合;
D.定容时俯视容量瓶刻度线,溶液凹液面在刻度线以下,导致所配溶液体积偏小,所配溶液浓度偏高,故D符合;
故选BD;
(4)①反应MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O中,Mn元素的化合价由+4降低为+2价,Cl元素的化合价由-1升高为0价,转移的电子数为:2e-,则双线桥法标出电子得失的方向和数目为:
 ;
;故答案为:
 ;
;②令标准状况生成氯气的体积为V,则:
MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O
87g 22.4L
8.7g V
所以:87g:8.7g=22.4L:V
解得:V=2.24L
答:标准状况生成氯气的体积为2.24L;
③标准状况下2.24L氯气的物质的量为
| 2.24L |
| 22.4L/mol |
故答案为:0.2.
点评:本题考查一定物质的量浓度溶液的配制、氧化还原反应及有关计算等,难度不大,注意根据c=
理解溶液的配制与误差分析.
| n |
| V |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
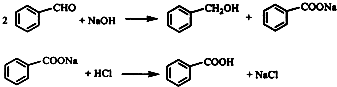






 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
