题目内容
18.碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中.碘酸钾是一种白色结晶粉末,常温下很稳定,加热至560℃开始分解.KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产.(1)完成并配平第一步反应的化学方程式:5H2O2+1I2→2HIO3+4H2O,比较氧化性强弱:H2O2>HIO3 (填“>”、“<”或“=”)
(2)烹饪时,含KIO3 的食盐常在出锅前加入,其原因是在较高温度下KIO3 易分解.
(3)若制得1.28kgKIO3 固体,理论上至少需消耗质量分数为30%的双氧水1.7kg.
分析 (1)结合元素化合价的变化以及质量守恒配平方程式;根据氧化性大于氧化产物判断氧化性强弱;
(2)碘酸钾加热容易分解,热稳定性差;
(3)KIO3的摩尔质量是214g/mol,1.28kg固体的物质的量是6mol;根据化合价升降相等列出碘酸钾和双氧水的关系式:2KIO3~5H2O2;求出双氧水的物质的量,再计算出双氧水溶液的质量.
解答 解:(1)反应中O元素化合价由-1价降低到-2价,则H2O2为氧化剂,I元素化合价由0价升高到+5价,则HIO3为氧化产物,根据得失电子守恒,方程式为5H2O2+I2=2HIO3+4H2O,根据氧化性大于氧化产物,则氧化性强弱:H2O2>HIO3,
故答案为:5;1;2;4H2O;>;
(2)由于碘酸钾的热稳定性较差,烹饪时,含KIO3 的食盐常在出锅前加入;
故答案是:在较高温度下KIO3 易分解;
(3)1.28kg KIO3固体的物质的量是6mol,根据化合价升降相等,I2→IO3-化合价升高5价、H2O2→H2O化合价降低2价,关系式为:2KIO3~5H2O2
n(H2O2)=$\frac{5}{2}$n(IO3-)=$\frac{5}{2}$×6mol=15mol;消耗质量分数为30%的双氧水的质量为:$\frac{15mol×34g/mol}{30%}$=1700g=1.7kg;
故答案是:1.7.
点评 本题考查氧化还原反应的计算,为高频考点,把握实验原理反应中元素的化合价变化及物质的量关系为解答的关键,侧重分析与应用、计算能力的考查,题目难度不大.

练习册系列答案
相关题目
9. 298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
 298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )
298K时,分别向体积、浓度均为20mL0.1mol•L-1的HX溶液、HY溶液中滴加等浓度的NaOH 溶液,混合溶液的pH与加入NaOH溶液体积(V)之间的关系如图所示.(注明:弱电解质的电离度等于已电离的电解质的量与电解质总量之比)下列说法正确的是( )| A. | 298K 时,0.1mol•L-1HX 溶液中HX的电离度为1% | |
| B. | V=10mL时,同时微热溶液(忽略体积变化),$\frac{c({X}^{-})}{c({Y}^{-})}$逐渐增大 | |
| C. | V=20mL 时,HX曲线对应的溶液中c(Na+)=c(X-)>c(H+)=c(OH-) | |
| D. | 滴定这两种溶液时都可以选择甲基橙替代酚酞作指示剂 |
13.下列属于烯烃的是( )
| A. | CH3CH2CH3 | B. | CH2=CHCH3 | C. | CH2=CHCH2Cl | D. | CH2=CHCOOH |
10.某工业废水中仅含表离子中的5种,且各种离子的物质的量浓度相等.均为0.1mol•L-1.
欲探究废水的组成,进行如下实验:
I.用铂丝蘸取少量溶液液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄淸.且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中听得的溶液中加入BaCl2溶液,有白色沉淀生成.
(1)仅由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+ (写离子符号).
(2)将Ⅲ中所得红棕色气体通人水中,气体变无色,所发生的化学方程式为:3NO2+H2O═2HNO3+NO.
(3)原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO32- NO3- SO42- SiO32- |
I.用铂丝蘸取少量溶液液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄淸.且溶液中阴离子种类不变.
Ⅳ.向Ⅲ中听得的溶液中加入BaCl2溶液,有白色沉淀生成.
(1)仅由I、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+ (写离子符号).
(2)将Ⅲ中所得红棕色气体通人水中,气体变无色,所发生的化学方程式为:3NO2+H2O═2HNO3+NO.
(3)原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
7.某同学将铁片A和碳棒B用导线连接后放入食盐水中模拟菜刀生锈过程,则下列叙述错误的是( )
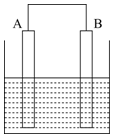

| A. | 导线中有电子流动,电流方向为A流向B | |
| B. | 溶液中的O2在电极B得电子,电极B附近碱性增强 | |
| C. | 电极A上的电极反应式为Fe-2e-=Fe2+ | |
| D. | 溶液中的Na+向电极B附近移动 |
8.下列科学家与其科学成果对应关系正确的是( )
| A. | 道尔顿:分子学说 | B. | 汤姆生:射线的发现 | ||
| C. | 卢瑟福:原子结构的行星模型 | D. | 伦琴:原子的葡萄干面包模型 |

 ;
;