题目内容
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
|
c(HA) |
c(KOH) |
||
|
① |
0.1 |
0.1 |
9 |
|
② |
x |
0.2 |
7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= 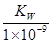 mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)
B
【解析】根据表的信息可知实验①的溶液显碱性,则HA是弱酸,根据电荷守恒可知A项正确,c(K+)+c(H+)=c(A-)+c(OH-),则B项错误;若x=0.2,则反应后的溶液显碱性,而实验②的溶液呈中性,因此x>0.2,根据物料守恒可知C、D项正确;
【考点定位】本题考查中和反应及离子浓度比较。

(2013?四川)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| ||||||||||||||
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
|
c(HA) |
c(KOH) |
||
|
① |
0.1 |
0.1 |
9 |
|
② |
x |
0.2 |
7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) =Kw/(1x10-9)mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
实验 编号 |
c(HA)起始浓度/(mol·L-1) |
c(KOH)起始浓度/(mol·L-1) |
反应后溶液的pH |
|
① |
0.1 |
0.1 |
9 |
|
② |
x |
0.2 |
7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.0.1 mol·L-1HA的溶液中由水电离出的 c(H+)=1×10-13 mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)