题目内容
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
B、分析判断酸是弱酸电离平衡状态下氢离子浓度远小于0.1mol/L,水电离出的氢离子浓度大于1×10-13mol/L;
C、依据混合后溶液PH=7 常温下呈中性是弱酸过量,结合溶液中电荷守恒分析;
D、依据溶液中电荷守恒分析判断;
B、0.1 mol?L-1HA的溶液是弱电解质,存在电离平衡,溶液中氢离子浓度小于0.1mol/L每一句溶液中离子积常数可知,由水电离出的 c(H+)>1×10-13mol/L,故B错误;
C、混合后溶液PH=7 常温下呈中性是弱酸HA过量,溶液中是HA和KA的混合溶液,HA的强酸浓度大于0.2mol/L,实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L,故C正确;
D、混合后溶液PH=7,c(OH-)=c(H+),溶液中存在电荷守恒,c(K+)+c(H+)=c(OH-)+c(A-),反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+),故D正确;
故选B.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(2013?四川)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
| ||||||||||||||
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
|
c(HA) |
c(KOH) |
||
|
① |
0.1 |
0.1 |
9 |
|
② |
x |
0.2 |
7 |
下列判断不正确的是( )
A. 实验①反应后的溶液中:c(K+) > c(A—) > c(OH—) > c(H+)
B. 实验①反应后的溶液中:c(OH—) = c(K+) — c(A—) =Kw/(1x10-9)mol/L
C.实验②反应后的溶液中:c(A—) + c(HA) > 0.1 mol/L
D.实验②反应后的溶液中:c(K+) = c(A—) > c(OH—) = c(H+)
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
实验 编号 |
c(HA)起始浓度/(mol·L-1) |
c(KOH)起始浓度/(mol·L-1) |
反应后溶液的pH |
|
① |
0.1 |
0.1 |
9 |
|
② |
x |
0.2 |
7 |
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.0.1 mol·L-1HA的溶液中由水电离出的 c(H+)=1×10-13 mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
|
实验编号 |
起始浓度/(mol·L-1) |
反应后溶液的pH |
|
|
c(HA) |
c(KOH) |
||
|
① |
0.1 |
0.1 |
9 |
|
② |
x |
0.2 |
7 |
下列判断不正确的是
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)= 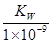 mol/L
mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1mol·L-1
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-) =c(H+)