题目内容
【题目】某学生兴趣小组模拟工业制取无水Na2SO3的过程如下:

已知:①反应Ⅰ在三颈烧瓶中发生,装置如图所示(固定及加热类仪器省略);
②H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图;
③Na2SO3·7H2O 和Na2SO3的溶解度曲线如图。
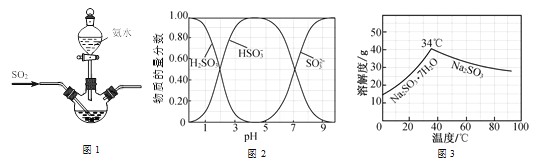
(1)为提高Na2SO3产率,反应Ⅰ应控制pH在_____左右。
(2)反应Ⅱ所得滤液的主要成分是_____和Na2SO3。
(3)将操作Ⅰ后所得的Na2SO3溶液_____(填操作),过滤出的固体用无水乙醇洗涤、在真空干燥箱中采用150℃干燥,得无水Na2SO3固体。
(4)可以用KIO3测定产品中无水Na2SO3的纯度:称取0.1260 g样品于锥形瓶中,用蒸馏水溶解,并加入淀粉做指示剂,滴加酸性KIO3溶液(a mol·L-1)至Na2SO3恰好完全氧化成Na2SO4,发生反应3Na2SO3 + KIO3 = 3Na2SO4 + KI,消耗KIO3溶液体积为b mL。通过计算确定样品中Na2SO3的质量分数(写出计算过程)____
(5)滴加酸性KIO3溶液时,剧烈震荡锥形瓶或者滴加时间过长都会造成所测Na2SO3纯度偏低,原因是_____。
【答案】9.5(9.4-10之间的值均可给分) NH4Cl 加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤 消耗KIO3的物质的量为a×10-3 L×b mol·L-1= ab×10-3 mol
由题给反应可得关系式:3 Na2SO3 ~ KIO3,
可知n(Na2SO3) = 3n(KIO3) = 3 ab×10-3 mol
则成品中Na2SO3的质量分数为 3ab×100% 空气中氧气将Na2SO3氧化
【解析】
(1)由H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布图可知,Na2SO3的物质的量分数在pH=9.5左右最大;
(2)反应Ⅱ是亚硫酸铵与氯化钠反应生成NH4Cl和Na2SO3,故所得滤液的主要成分是NH4Cl和Na2SO3;
(3) 由Na2SO3·7H2O 和Na2SO3的溶解度曲线可知温度高于34℃条件下有利于Na2SO3析出,故将操作Ⅰ后所得的Na2SO3溶液加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤;
(4) 由题给反应可得关系式:3Na2SO3 ~ KIO3,根据反应关系计算;
(5)剧烈震荡锥形瓶或者滴加时间过长都会使空气中氧气将Na2SO3氧化,造成所测Na2SO3纯度偏低。
(1)由H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布图可知,Na2SO3的物质的量分数在pH=9.5左右最大;
因此,本题正确答案是:9.5(9.4-10之间的值均可给分);
(2)反应Ⅱ是亚硫酸铵与氯化钠反应生成NH4Cl和Na2SO3,故所得滤液的主要成分是NH4Cl和Na2SO3;
因此,本题正确答案是:NH4Cl;
(3) 由Na2SO3·7H2O 和Na2SO3的溶解度曲线可知温度高于34℃条件下有利于Na2SO3析出,故将操作Ⅰ后所得的Na2SO3溶液加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤;
因此,本题正确答案是:加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤;
(4) 消耗KIO3的物质的量为a×10-3 L×b mol·L-1= ab×10-3 mol,
由题给反应可得关系式:3 Na2SO3 ~ KIO3,
可知n(Na2SO3) = 3n(KIO3) = 3 ab×10-3 mol
则产品中Na2SO3的质量分数为 ![]() ×100%=3ab×100%;
×100%=3ab×100%;
因此,本题正确答案是:3ab×100%;
(5)剧烈震荡锥形瓶或者滴加时间过长都会使空气中氧气将Na2SO3氧化,造成所测Na2SO3纯度偏低。
因此,本题正确答案是:空气中氧气将Na2SO3氧化。

 阅读快车系列答案
阅读快车系列答案