题目内容
【题目】化学实验装置的科学设计是实验是否取得预期效果的关键。请回答下列有关实验装置的相关问题:
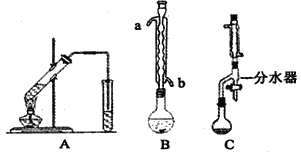
I.图A为教材制备乙酸乙酯的实验装置,甲同学认为图B装置比A要好,则冷却水应从_______口进入;乙同学认为图C装置效果更好,理由是________________。
Ⅱ.“摩尔盐”[(NH4)2Fe(SO4)2·6H2O]是分析化学中的重要试剂。已知:摩尔盐隔绝空气加热至500℃时可完全分解。某学习小组欲探究其分解产物。
(1)(提出猜想)小组同学认为分解产物可能有以下几种情况:
A.Fe2O3SO2NH3H2O B.FeO SO3NH3H2O
C.FeO SO2NH3H2O D.Fe2O3SO3SO2NH3H2O
根据所学知识,可确定______________不成立(填序号)
(2)(药品验纯)甲同学提出可以用湿润的红色石蕊试纸、稀盐酸和__________溶液检验出“摩尔盐”中的三种离子;取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加______________(填试剂名称和实验现象),则“摩尔盐”未因氧化而变质。
(3)(实验探究)为检验分解产物,甲同学设计了如下实验装置。

①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是__________。
②实验中观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀。C中发生反应的离子方程式为_____。
③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含_______。
(4)(实验结论与反思)通过实验现象和认真反思,上述猜想中一定正确的是_________(填序号)。
【答案】b 既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成 C Ba(OH)2溶液 硫氰化钾溶液,溶液不变血红色 将分解产生的气体全部排到B、C装置中使其全部被吸收 SO2+H2O2+Ba2+![]() BaSO4+2H+ FeO D
BaSO4+2H+ FeO D
【解析】
I.醋酸和乙醇易挥发,B装置有冷凝回流装置,可提高原料的利用率。为提高冷凝效果,则冷却水应从b口进入;图C装置效果更好,理由是既能冷凝回流又能及时分离出反应生成的水,有利于酯的生成。
Ⅱ. (1)根据氧化还原反应的知识分析元素化合价有升高的必有降低的,C中只有硫元素的化合价降低,没有化合价升高的元素,可确定C不成立。
(2)NH4+的检验可加入碱溶液,加热,产生使湿润红色石蕊试纸变蓝的气体;Fe2+与OH-离子反应先生成白色沉淀,迅速变为灰绿色,最后变为红褐色,可用碱溶液检验Fe2+,SO42-与Ba2+反应生成不溶于稀盐酸的白色沉淀,故可以用湿润的红色石蕊试纸、稀盐酸和Ba(OH)2溶液检验出“摩尔盐”中的三种离子;“摩尔盐”变质,Fe2+被氧化为Fe3+。检验“摩尔盐”是否变质可检验Fe3+是否存在。取一定量的“摩尔盐”配成溶液,取少量溶液置于试管中,向其中滴加硫氰化钾溶液,溶液不变血红色,则“摩尔盐”未因氧化而变质。
(3)①取一定量“摩尔盐”置于加热管A中,加热至分解完全后打开K,再通入N2,目的是将分解产生的气体全部排到B、C装置中使其全部被吸收。②实验中观察到A中固体逐渐变为红棕色,有氧化铁生成,B、C中均产生白色沉淀,白色沉淀为硫酸钡,则分解产物中含有二氧化硫和三氧化硫。C中二氧化硫与H2O2和BaCl2的混合液反应生成硫酸钡沉淀,发生反应的离子方程式为SO2+H2O2+Ba2+![]() BaSO4+2H+。③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含FeO。
BaSO4+2H+。③实验验证取A中残留物少许加入稀硫酸溶解,再滴入KMnO4稀溶液,不褪色证明产物不含FeO。
(4)根据上述分析知,“摩尔盐”分解的产物为Fe2O3、SO3、SO2 、NH3和H2O,上述猜想中一定正确的是D。

 阅读快车系列答案
阅读快车系列答案