题目内容
【题目】1mol某烃在足量的氧气中完全燃烧,生成CO2和水各6mol,
(1)则该烃的分子式为;
(2)若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2﹣二甲基丁烷,则此烃属于烃,结构简式为 , 名称是 . 写出该烃与溴水反应的化学方程式: . 核磁共振氢谱有个吸收峰,峰面积之比是 .
【答案】
(1)C6H12
(2)烯;(CH3)3CCH=CH2;3,3﹣二甲基﹣1﹣丁烯;(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br;3;9:1:2
【解析】解:(1)烃只含C、H元素,1mol某烃在足量的氧气中完全燃烧,生成CO2和水各6mol,则分子中含C为 ![]() =6,含H原子为
=6,含H原子为 ![]() =12,该烃的分子式为C6H12 , 所以答案是:C6H12;(2)该烃能使溴水褪色,说明分子中含有1个C=C键,该烃属于烯烃,在催化剂作用下与H2加成生成2,2﹣二甲基丁烷(
=12,该烃的分子式为C6H12 , 所以答案是:C6H12;(2)该烃能使溴水褪色,说明分子中含有1个C=C键,该烃属于烯烃,在催化剂作用下与H2加成生成2,2﹣二甲基丁烷( ![]() ),相邻两个碳原子都含有H原子为C=C双键位置,该烃的结构简式为:(CH3)3CCH=CH2 , 名称为3,3﹣二甲基﹣1﹣丁烯,与溴水反应的方程式为:(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br,(CH3)3CCH=CH2中含3种H,核磁共振氢谱有3个吸收峰,峰面积之比是9:1:2,
),相邻两个碳原子都含有H原子为C=C双键位置,该烃的结构简式为:(CH3)3CCH=CH2 , 名称为3,3﹣二甲基﹣1﹣丁烯,与溴水反应的方程式为:(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br,(CH3)3CCH=CH2中含3种H,核磁共振氢谱有3个吸收峰,峰面积之比是9:1:2,
所以答案是:烯;(CH3)3CCH=CH2;3,3﹣二甲基﹣1﹣丁烯;(CH3)3CCH=CH2+Br2→(CH3)3CCHBrCH2Br;3;9:1:2.

【题目】二草酸合铜(Ⅱ)酸钾{K2[Cu(C2O4)2]2H2O}制备流程如图1: 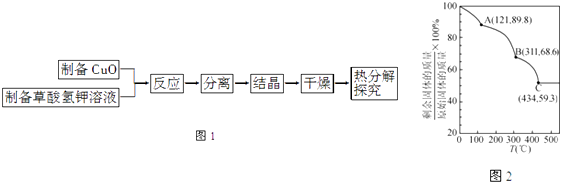
(已知H2C2O4 ![]() CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤.①用双层滤纸的可能原因是 .
②用蒸馏水洗涤氧化铜时,如何证明已洗涤干净:
(2)本实验用K2CO3粉末与草酸溶液制取KHC2O4溶液而不用KOH粉末代替K2CO3粉末的可能原因是 .
(3)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中:;50℃水浴加热至反应充分,发生反应的化学方程式为;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得二草酸合铜(Ⅱ)酸钾晶体.
(4)若实验室只有含少量FeSO47H2O的硫酸铜晶体,欲制备较纯净的CuSO4溶液.
Ⅰ.相关数据(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 5.8 | 8.8 |
Ⅱ.提供的试剂有:a.蒸馏水 .稀硫酸 .H2O2溶液 d.纯净的Cu(OH)2粉末 .氨水
需经过的步骤有:①、②、③、④过滤得CuSO4溶液.
(5)将制得的K2[Cu(C2O4)2]2H2O进行热重分析,结果如图2,由图2知在C点剩余固体为K2CO3和 .