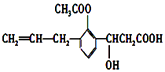
题目内容
【题目】火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S===K2S+N2↑+3CO2↑。
(1)其中被还原的元素是________,被氧化的元素是_________,氧化剂是_________,还原剂是_________,氧化产物是_________,还原产物是__________。
(2)用双线桥标出电子转移的方向和数目:2KNO3+ 3C+ S ═ K2S + N2↑+ 3CO2↑________。
(3)当0.1molCO2生成时,则转移的电子数为___________个。
【答案】 N、S C S、KNO3 C CO2 N2、K2S 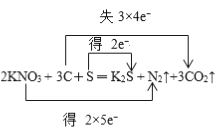 0.4NA或者2.408×1023
0.4NA或者2.408×1023
【解析】本题考查氧化还原反应中几组概念、双线桥表示电子转移方向以及电子转移数目,(1)氧化剂化合价降低,被还原,根据反应方程式,N的化合价由+5价→0价,被还原,S的化合价由0价→-2价,化合价降低,被还原,因此被还原的元素是N和S,还原剂是化合价升高,被氧化,C的化合价由0价→+4价,化合价升高,因此被氧化的元素是C,氧化剂是S和KNO3,还原剂是C,氧化产物是还原剂被氧化得到,因此氧化产物是CO2,还原产物是氧化剂被还原得到物质,因此还原产物是K2S和N2;(2)用双线桥表示此反应转移的方向和数目,即为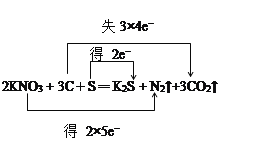 ;(3)转移电子物质的量为0.1×4mol=0.4mol,即转移电子个数为0.4NA或者2.408×1023。
;(3)转移电子物质的量为0.1×4mol=0.4mol,即转移电子个数为0.4NA或者2.408×1023。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热).
若改变条件使平衡向正反应方向移动,则平衡常数(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO)不变
c.v逆(H2)=v正(H2O) d.c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应 CO (g)+H2O (g)CO2(g)+H2(g),得到如表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 900 | a | b | c | d | t |
①通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”),该反应的正反应为(填“吸”或“放”)热反应.
②若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是(用含a、b的数学式表示).