题目内容
【题目】二草酸合铜(Ⅱ)酸钾{K2[Cu(C2O4)2]2H2O}制备流程如图1: 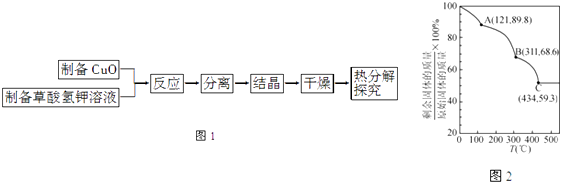
(已知H2C2O4 ![]() CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤.①用双层滤纸的可能原因是 .
②用蒸馏水洗涤氧化铜时,如何证明已洗涤干净:
(2)本实验用K2CO3粉末与草酸溶液制取KHC2O4溶液而不用KOH粉末代替K2CO3粉末的可能原因是 .
(3)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中:;50℃水浴加热至反应充分,发生反应的化学方程式为;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得二草酸合铜(Ⅱ)酸钾晶体.
(4)若实验室只有含少量FeSO47H2O的硫酸铜晶体,欲制备较纯净的CuSO4溶液.
Ⅰ.相关数据(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 5.8 | 8.8 |
Ⅱ.提供的试剂有:a.蒸馏水 .稀硫酸 .H2O2溶液 d.纯净的Cu(OH)2粉末 .氨水
需经过的步骤有:①、②、③、④过滤得CuSO4溶液.
(5)将制得的K2[Cu(C2O4)2]2H2O进行热重分析,结果如图2,由图2知在C点剩余固体为K2CO3和 .
【答案】
(1)防止CuO颗粒穿过滤纸或者防止滤纸破损;取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀说明已洗涤干净
(2)H2C2O4与KOH发生显著的放热反应,导致草酸大量分解
(3)直接将洗涤干净的CuO固体连同滤纸一起投入到KHC2O4溶液中;2KHC2O4+CuO ![]() K2[Cu(C2O4)2]+H2O
K2[Cu(C2O4)2]+H2O
(4)将含有杂质的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中;加入足量的H2O2溶液;纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间)
(5)Cu2O
【解析】解:(1)①从过滤的目的为了除尽不溶的固体,用双层滤纸的可能原因是防止CuO颗粒穿过滤纸;从过滤时滤纸易破损,用双层滤纸的可能原因是防止滤纸破损,所以答案是:防止CuO颗粒穿过滤纸或者防止滤纸破损;②可以检验是否存在硫酸根离子来检验是否洗涤干净,具体方法是:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀说明已洗涤干净,所以答案是:取最后一次洗涤滤液,滴入BaCl2溶液,若无白色沉淀说明已洗涤干净;(2)因为草酸易分解,又氢氧化钾为强碱溶解放热,与草酸反应也放热,会导致溶液温度过高使草酸分解,所以不用KOH粉末代替K2CO3粉末,所以答案是:H2C2O4与KOH发生显著的放热反应,导致草酸大量分解;(3)过滤时滤纸上沾有大量的氧化铜固体,所以应直接将洗涤干净的氧化铜固体连同滤纸一起加入到草酸氢钾溶液中,充分反应后取出滤纸;根据题意,反应的方程式为:2KHC2O4+CuO ![]() K2[Cu(C2O4)2]+H2O,所以答案是:直接将洗涤干净的CuO固体连同滤纸一起投入到KHC2O4溶液中;2KHC2O4+CuO
K2[Cu(C2O4)2]+H2O,所以答案是:直接将洗涤干净的CuO固体连同滤纸一起投入到KHC2O4溶液中;2KHC2O4+CuO ![]() K2[Cu(C2O4)2]+H2O;(4)实验需除去晶体中的杂质FeSO47H2O晶体,亚铁离子一般要先氧化成铁离子,再条件PH值转化成氢氧化铁沉淀而除去,对于固体一般要先配成溶液,所以步骤①为将含少量FeSO47H2O的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中②加入足量的H2O2溶液③用纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间),
K2[Cu(C2O4)2]+H2O;(4)实验需除去晶体中的杂质FeSO47H2O晶体,亚铁离子一般要先氧化成铁离子,再条件PH值转化成氢氧化铁沉淀而除去,对于固体一般要先配成溶液,所以步骤①为将含少量FeSO47H2O的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中②加入足量的H2O2溶液③用纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间),
所以答案是:①将含有杂质的硫酸铜晶体溶于稀硫酸酸化的蒸馏水中;②加入足量的H2O2溶液;③用纯净的Cu(OH)2粉末调节溶液pH约为4(或3.2~4.7之间);(5)分解后的固体为钾的化合物和铜的化合物,且钾与铜原子个数比为2:1,设K2[Cu(C2O4)2]2H2O参与反应,C点生成1mol K2CO3 , 则铜的化合物质量为354×0.593﹣138=72,铜元素含量为1mol,质量64g,剩余8g,只能为氧元素且物质的量为0.5mol,故为Cu2O,所以答案是:Cu2O.

【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热).
若改变条件使平衡向正反应方向移动,则平衡常数(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是
a.容器中压强不变 b.混合气体中c(CO)不变
c.v逆(H2)=v正(H2O) d.c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应 CO (g)+H2O (g)CO2(g)+H2(g),得到如表三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 900 | a | b | c | d | t |
①通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”),该反应的正反应为(填“吸”或“放”)热反应.
②若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是(用含a、b的数学式表示).

