题目内容
12.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质.已知:甲+乙=丁+己,甲+丙=戊+己; 0.1mol•L-1丁溶液的pH为13(25℃),下列说法正确的是( )| A. | 1 mol甲与足量的乙完全反应共转移了1 mol电子 | |
| B. | Y元素在周期表中的位置为第三周期第ⅣA族 | |
| C. | 原子半径:W>Z>Y>X | |
| D. | 1.0 L 0.1 mol•L-1戊溶液中阴离子总的物质的量小于0.1 mol |
分析 0.1 mol•L-1丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+己,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,己是由Z组成的单质,由发生反应可知,己不能是Na,结合原子序数可知,X为H、Z为O、W为Na元素,故己为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+己,可知丙是二氧化碳,戊是碳酸钠,则Y为C,结合对应单质、化合物的性质以及题目要求可解答该题.
解答 解:0.1 mol•L-1丁溶液的pH为13(25℃),丁是一元强碱,其含有的金属元素在短周期,则丁应为NaOH,发生反应:甲+乙=丁+己,根据元素守恒可知,甲、乙两种物质至少共含有H、O、Na元素,己是由Z组成的单质,由发生反应可知,己不能是Na,结合原子序数可知,X为H、Z为O、W为Na元素,故己为氧气,可知甲是Na2O2、乙是水,再根据反应:甲+丙=戊+己,可知丙是二氧化碳,戊是碳酸钠,则Y为C.
A.甲与足量的乙完全反应的方程式为:2Na2O2+2H2O═4NaOH+O2↑,反应中过氧化钠其氧化剂、还原剂作用,各占一半,故1molNa2O2反应转移的电子为1mol×$\frac{1}{2}$×2=1mol,故A正确;
B.Y为碳,在周期表中的位置为:第二周期第ⅣA族,故B错误;
C.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,H原子半径最小,则原子半径大小顺序为:Na>C>O>H,即:W>Y>Z>X,故C错误;
D.戊是碳酸钠,在碳酸钠溶液中,CO32-离子水解生成HCO3-离子和OH-离子,溶液中阴离子总的物质的量大于0.1mol,故D错误,
故选A.
点评 本题考查元素化合物推断,题目难度中等,需要学生熟练掌握元素化合物知识,丁溶液pH值是推断突破口,对学生的逻辑推理有一定的要求,D选项注意盐类水解.

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案 元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )
元素周期表是学习化学的重要工具.下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是( )| A. | 该元素的三种核素质子数均为6 | B. | 该元素原子最外层有4个电子 | ||
| C. | 该元素的相对原子质量为12.01 | D. | 该元素的原子核外有三个电子层 |
 已知下表所示数据:
已知下表所示数据:| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按如图连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管 5~10 min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层.
④分离出乙酸乙酯层,洗涤、干燥.
请根据题目要求回答下列问题:
(1)配制该混合液的主要操作步骤为在一个30 mL的大试管中注入3 mL乙醇,再分别缓缓加入2 mL浓硫酸、3mL 乙酸(乙醇和浓硫酸的加入顺序不可互换),边加边振荡试管使之混合均匀.
(2)导管不能插入到Na2CO3溶液中的原因是防止倒吸回流现象的发生.
(3)步骤②中需要小火均匀加热,其主要原因是反应物乙醇、乙酸的沸点较低,若用大火加热,反应物随产物蒸出而大量损失,而且温度过高可能发生更多的副反应.
(4)指出步骤③所观察到的现象:试管B中的液体分成上下两层,上层无色,下层为红色液体,振荡后下层液体的红色变浅;
(5)充分振荡试管,然后静置,待液体分层后,分液得到的上层液体即为乙酸乙酯.分离出乙酸乙酯层后,可以用用B洗涤.
A.乙醇 B.饱和食盐水
C.碳酸钠溶液 D.NaOH溶液.
| A. | a+3b | B. | $\frac{a}{2}$+3b | C. | $\frac{a}{2}$+3b+$\frac{7w}{2}$ | D. | $\frac{a}{2}$+3b-$\frac{7w}{2}$ |
| A. | P4(白磷、s)+3O2(g)═2P2O3(s)△H=-1638 kJ/mol | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3 kJ/mol | |
| C. | 2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol | |
| D. | H2(g)+1/2O2(g)═H2O(l)△H=-285.8 kJ/mol |
| A. | Zn与盐酸反应 | B. | CaO与H2O反应 | C. | NaOH与盐酸反应 | D. | C和H2O(g)反应 |
| A. | 二者都能使溴的四氯化碳溶液褪色 | B. | 二者互为同系物 | ||
| C. | 二者实验式相同 | D. | 聚乙烯是乙烯的缩聚产物 |
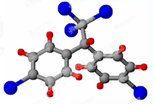 按要求完成下列问题:
按要求完成下列问题: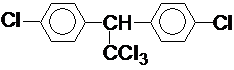 ;
;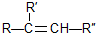 在一定条件下氧化可得产物
在一定条件下氧化可得产物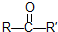 和
和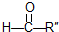 .某烃1mol在一定条件下氧化得到产物
.某烃1mol在一定条件下氧化得到产物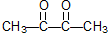 和OHCCH2CH2CHO各1mol.这种烃的结构简式是
和OHCCH2CH2CHO各1mol.这种烃的结构简式是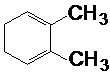 .
.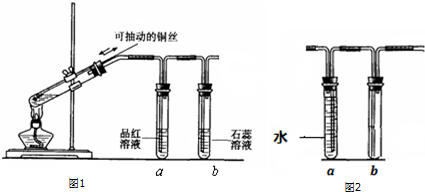 几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设
几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设