题目内容
10.常温下,下列各组离子在指定溶液中可能大量共存的是( )| A. | 滴加甲基橙显黄色的溶液:Na+、NO3-、SO32-、Fe3+ | |
| B. | 加入Al粉能放出H2的溶液:Al3+、NO3-、HCO3-、Ba2+ | |
| C. | c(OH -)水=1×10-12的溶液:K+、NH4+、Cl -、SO42- | |
| D. | 能使pH试纸显深红色的溶液:Fe 2+、Cl -、Ba 2+、ClO - |
分析 A.滴加甲基橙显黄色的溶液为酸性或碱性溶液,铁离子能够以后亚硫酸根离子,铁离子与氢氧根离子反应,酸性条件下硝酸根离子能够以后亚硫酸根离子;
B.加入Al粉能放出H2的溶液中存在大量氢离子或氢氧根离子,铝离子与碳酸氢根离子发生双水解反应,铝离子、碳酸氢根离子都与氢氧根离子反应,碳酸氢根离子还与氢离子反应;
C.c(OH -)水=1×10-12的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
D.使pH试纸显深红色的溶液为酸性溶液,溶液中存在大量氢离子,次氯酸根离子能够以后亚铁离子,次氯酸根离子能够与氢离子反应生成次氯酸.
解答 解:A.滴加甲基橙显黄色的溶液的pH>4.4,可能为酸性或碱性溶液,SO32-、Fe3+之间发生氧化还原反应,NO3-、SO32-在酸性条件下发生氧化还原反应,Fe3+与碱性溶液中的氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.加入Al粉能放出H2的溶液为酸性或强碱性溶液,Al3+、HCO3-之间发生双水解反应,且二者都与氢氧根离子反应,HCO3-还与氢离子反应,酸性条件下NO3-具有强氧化性,与铝反应不会生成氢气,在溶液中一定不能大量共存,故B错误;
C.c(OH -)水=1×10-12的溶液中氢离子浓度为0.01mol/L,K+、NH4+、Cl -、SO42-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故C正确;
D.使pH试纸显深红色的溶液中存在大量氢离子,Fe2+、ClO-之间发生氧化还原反应,ClO -与氢离子反应生成次氯酸,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

 阅读快车系列答案
阅读快车系列答案| A. | 冰融化 | B. | 光合作用 | C. | 白炽灯发光 | D. | 焰色反应 |
| A. | Cu2++2OH-═Cu(OH)2↓ CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓ | |
| B. | CO32-+2H+═CO2↑+H2O NaHCO3+HCl═NaCl+CO2↑+H2O | |
| C. | H++OH-═H2O NaOH+HNO3═NaNO3+H2O | |
| D. | SO42-+Ba2+═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O |
| A. | 能量变化是化学反应的基本特征之一 | |
| B. | 需加热的化学反应未必都是吸热反应 | |
| C. | 化学反应中的能量变化只与反应物的状态有关与其质量无关 | |
| D. | 石墨转化为金刚石是吸热反应说明金刚石总能量更高 |
| A. | 2c(H2CO3 )+c(H +)+c(HCO3-)=c(OH -) | B. | c(CO32-)+c(HCO3-)+c(H2CO 3)=2 c(Na+) | ||
| C. | 2c(CO32-)+c(HCO3-)=c(H +)+c(Na+) | D. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH -)>c(H+) |
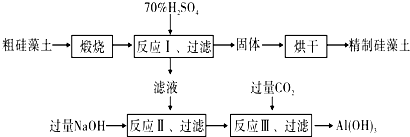
(1)该工艺流程中多处涉及到过滤操作,其需要用到的玻璃仪器主要有烧杯、玻璃棒、(普通)漏斗.
(2)假设所得反应Ⅰ的滤液中各种金属阳离子的浓度均为0.001mol/L( 查数据可知部分难溶物的溶度积Ksp数值如下表所示(25℃))
| 难溶物 | 溶度积Ksp |
| Mg(OH)2 | 1.8×10-11 |
| Al(OH)3 | 1.0×10-33 |
| Fe(OH)3 | 8.0×10-38 |
②当Fe3+恰好沉淀完全时溶液的PH值为3.3.(已知:lg2=0.3)
(3)反应Ⅲ中生成Al(OH)3沉淀的离子方程式是AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓.
(4)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解.
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液.
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤.
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF).
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol/L NaOH的标准溶液滴定至终点,消耗NaOH标准溶液V mL.
①步骤3中采用饱和KCl溶液洗涤沉淀,其目的是洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失.
②步骤5中判断滴定终点的现象是最后一滴滴入后溶液由无色变为粉红色,且30s不褪色.
③已知样品中SiO2的质量分数可用公式“w(SiO2)=$\frac{15cV×1{0}^{-3}}{a}$×100%”进行计算.
由此分析步骤5中与NaOH标准溶液发生中和反应的酸为B.
A.H2SiO3 B.HF C.H2SiO3和HF D.无法确定
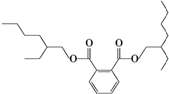
| A. | 塑化剂DEHP分子中含有碳、氢和氧三种元素 | |
| B. | 塑化剂DEHP分子中至少含有两种官能团 | |
| C. | 塑化剂DEHP分子易溶于酒精 | |
| D. | 塑化剂DEHP分子可发生取代反应 加成反应 |
| 元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
| 元素符号 | Na | Mg | Al | Si | p | S | Cl | Ar |
| 原子结构 示意图 |  | 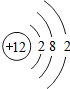 | 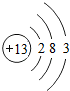 | 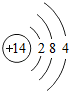 | 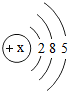 | 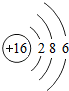 | 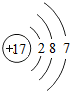 |  |
(1)表中磷原子的核电荷数x=15.
(2)表中具有相对稳定结构的元素是氩元素.
(3)镁元素与氯元素形成的化合物的化学式为MgCl2.
(4)上述元素在周期表中处于同一周期的原因是原子核外电子层数相同.
(5)在化学反应中,每个铝原子失去3个电子形成铝离子.
(6)硫与氧气反应的化学方程式是:S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2;设N个氧气分子的质量为32g,则64g氧气与足量硫粉完全反应生成的二氧化硫分子数为2N.
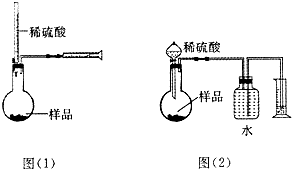 为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.请回答下列问题:
为测定NaOH、Na2C03混合物中Na2C03的质量分数,甲同学拟采用图(1)所示装置来测定.乙同学拟采用图(2)所示装置来测定.请回答下列问题: