题目内容
7.下列关于实验安全说法正确的是( )| A. | 少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 | |
| C. | 实验室可用燃着的酒精灯去点燃另一只酒精灯 | |
| D. | 将含硫酸的废液倒入水槽,用水冲入下水道 |
分析 A.根据浓硫酸的强腐蚀性和溶于水放热的角度分析;
B.蒸馏操作时,温度计需要测量馏分的温度,应该放在蒸馏烧瓶的支管口处;
C.对燃易引起火灾;
D.硫酸具有腐蚀性,用水冲入下水道会污染地下水.
解答 解:A.浓硫酸溶于水并放热,且具有强腐蚀性,少量浓硫酸沾在皮肤上,应先用干抹布拭去,再用大量的水冲洗,最后涂上碳酸氢钠溶液,故A错误;
B.蒸馏时,温度计的水银球应该分子蒸馏烧瓶的支管口处,用于测量馏分温度,故B正确;
C.禁止酒精灯之间的对燃,对燃易引起火灾,故C错误;
D.含硫酸的废液没有经过处理后不能直接倒入水槽,应先导入废液缸中集中回收处理,故D错误.
故选B.
点评 本题考查了化学实验基本操作方法及安全事故的处理,题目难度不大,注意掌握常见的化学实验基本操作方法,明确化学安全及事故处理方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
17.冬季的降雪给机场和马路带来诸多不便,其中醋酸钾(CH3COOK)是融雪效果较好的融雪剂,下列关于醋酸钾说法正确的是( )
| A. | 1 mol CH3COOK的质量为98 g•mol-1 | |
| B. | CH3COOK的摩尔质量等于它的相对分子质量 | |
| C. | 一个CH3COOK微粒的质量约为98 g/NA | |
| D. | 含有6.02×1023个碳原子的CH3COOK的物质的量为1 mol |
18.下列离子方程式改写成化学方程式正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓ CuSO4+Ba(OH)2═Cu(OH)2↓+BaSO4↓ | |
| B. | CO32-+2H+═CO2↑+H2O NaHCO3+HCl═NaCl+CO2↑+H2O | |
| C. | H++OH-═H2O NaOH+HNO3═NaNO3+H2O | |
| D. | SO42-+Ba2+═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O |
15.常温下,在饱和Na2CO3溶液中下列关系正确的是( )
| A. | 2c(H2CO3 )+c(H +)+c(HCO3-)=c(OH -) | B. | c(CO32-)+c(HCO3-)+c(H2CO 3)=2 c(Na+) | ||
| C. | 2c(CO32-)+c(HCO3-)=c(H +)+c(Na+) | D. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH -)>c(H+) |
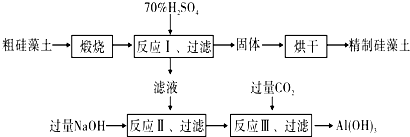
2.硅藻土是一种硅质岩石,主要分布在中国、美国等国.它主要由古代硅藻的遗骸所组成.其化学成分以SiO2为主,可用SiO2•nH2O表示,并含有少量的有机质、Al2O3、Fe2O3和MgO等杂质.如图是生产精制硅藻土并获得Al(OH)3的工艺流程.
(1)该工艺流程中多处涉及到过滤操作,其需要用到的玻璃仪器主要有烧杯、玻璃棒、(普通)漏斗.
(2)假设所得反应Ⅰ的滤液中各种金属阳离子的浓度均为0.001mol/L( 查数据可知部分难溶物的溶度积Ksp数值如下表所示(25℃))
①由数据分析可知,向反应Ⅰ的滤液中逐滴加入NaOH溶液,金属阳离子的沉淀顺序依次为:Fe3+>Al3+>Mg2+.(用“离子符号”回答)
②当Fe3+恰好沉淀完全时溶液的PH值为3.3.(已知:lg2=0.3)
(3)反应Ⅲ中生成Al(OH)3沉淀的离子方程式是AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓.
(4)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解.
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液.
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤.
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF).
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol/L NaOH的标准溶液滴定至终点,消耗NaOH标准溶液V mL.
①步骤3中采用饱和KCl溶液洗涤沉淀,其目的是洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失.
②步骤5中判断滴定终点的现象是最后一滴滴入后溶液由无色变为粉红色,且30s不褪色.
③已知样品中SiO2的质量分数可用公式“w(SiO2)=$\frac{15cV×1{0}^{-3}}{a}$×100%”进行计算.
由此分析步骤5中与NaOH标准溶液发生中和反应的酸为B.
A.H2SiO3 B.HF C.H2SiO3和HF D.无法确定
(1)该工艺流程中多处涉及到过滤操作,其需要用到的玻璃仪器主要有烧杯、玻璃棒、(普通)漏斗.
(2)假设所得反应Ⅰ的滤液中各种金属阳离子的浓度均为0.001mol/L( 查数据可知部分难溶物的溶度积Ksp数值如下表所示(25℃))
| 难溶物 | 溶度积Ksp |
| Mg(OH)2 | 1.8×10-11 |
| Al(OH)3 | 1.0×10-33 |
| Fe(OH)3 | 8.0×10-38 |
②当Fe3+恰好沉淀完全时溶液的PH值为3.3.(已知:lg2=0.3)
(3)反应Ⅲ中生成Al(OH)3沉淀的离子方程式是AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓.
(4)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解.
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液.
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤.
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF).
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol/L NaOH的标准溶液滴定至终点,消耗NaOH标准溶液V mL.
①步骤3中采用饱和KCl溶液洗涤沉淀,其目的是洗去沉淀表面的HF等杂质;增大K+浓度,减少K2SiF6的损失.
②步骤5中判断滴定终点的现象是最后一滴滴入后溶液由无色变为粉红色,且30s不褪色.
③已知样品中SiO2的质量分数可用公式“w(SiO2)=$\frac{15cV×1{0}^{-3}}{a}$×100%”进行计算.
由此分析步骤5中与NaOH标准溶液发生中和反应的酸为B.
A.H2SiO3 B.HF C.H2SiO3和HF D.无法确定

12.要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们( )
| A. | 溶解、过滤 | |
| B. | 制成热的硝酸钾饱和溶液,降温后再过滤 | |
| C. | 制成溶液后直接蒸干 | |
| D. | 先溶解、再蒸发结晶,趁热过滤 |
19.近日某著名白酒生产企业又陷入“塑化剂”事件.据称“塑化剂”大量超标的白酒被人饮用后,可引起肝癌.常见的塑化剂DEHP分子结构如图:关于该塑化剂的说法错误的是( )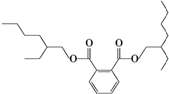

| A. | 塑化剂DEHP分子中含有碳、氢和氧三种元素 | |
| B. | 塑化剂DEHP分子中至少含有两种官能团 | |
| C. | 塑化剂DEHP分子易溶于酒精 | |
| D. | 塑化剂DEHP分子可发生取代反应 加成反应 |
15.下列氧化物中不属于酸性氧化物的是( )
| A. | CO2 | B. | NO2 | C. | SiO2 | D. | SO2 |