��Ŀ����
��CO2���建����ͨ�뵽��KOH��Ba(OH)2��KAlO2�Ļ����Һ��ֱ�����������ɳ��������ʵ�������ͨCO2�������ϵ��ͼ��ʾ�����й���������Ӧ�����еĸ�����������ȷ���ǣ� ��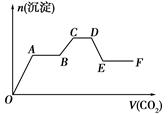
| A��O��A�η�Ӧ�Ļ�ѧ����ʽ��Ba(OH)2��CO2=BaCO3����H2O |
| B��B��C�η�Ӧ�����ӷ���ʽ��2AlO2-��3H2O��CO2=2Al(OH)3����CO32- |
| C��A��B����C��D���������ķ�Ӧ��ͬ |
| D��D��E�γ����ļ���������̼�ᱵ�������ʧ���� |
C
��������������ڸ����η����ķ�Ӧ��;O��A:Ba(OH)2��CO2=BaCO3����H2O. A��B��:2KOH+CO2=K2CO3��H2O.B��C:2AlO2-��3H2O��CO2=2Al(OH)3����CO32-;C��D��:K2CO3��H2O��CO2=2KHCO3��D��E�Σ�BaCO3��H2O+CO2=Ba(HCO3)2.
���㣺����CO2�����뺬KOH��Ba(OH)2��KAlO2�Ļ����ķ�Ӧ���Ⱥ������֪ʶ��

��Na2O2���뵽����Al3����Mg2����NH4���Ļ��Һ�в��ȣ�������������������ʵ�����mol)�����Na2O2�����ʵ����Ĺ�ϵ��ͼ��ʾ��ԭ��Һ��Al3����Mg2����NH4�������ʵ����ֱ�Ϊ
| A��2 mol��3 mol��8 mol |
| B��3 mol��2 mol��8 mol |
| C��2 mol��3 mol��4 mol |
| D��3 mol��2 mol��4 mol |
���и��������У�����Һ���ܴ������棬��������������Һ�г�������������ϡ����������ų�����
| A��Na����Ca2����SO42����CO32�� | B��K����Ba2����HCO3����Cl�� |
| C��K����Al3����SO42����NO3�� | D��K����Na����CO32����SO42�� |
����ͼʾ���Ӧ������������ǣ� ��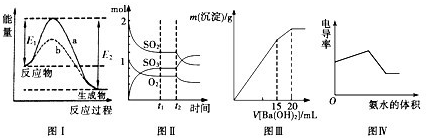
| A��ͼI��ʾij���ȷ�Ӧ������(a)���д���(b)ʱ��Ӧ�������仯 |
B��ͼ���ʾһ�������½��еķ�Ӧ2SO2��O2 2SO3���ɷֵ����ʵ����仯��t2ʱ�̸ı������������������SO2 2SO3���ɷֵ����ʵ����仯��t2ʱ�̸ı������������������SO2 |
| C��ͼ���ʾij������Һ�м���Ba(OH)2��Һ�����������������Ba(OH)2��Һ����Ĺ�ϵ���ڼ���20mLBa(OH)2��Һʱ������ǡ�ó�����ȫ |
| D���絼�ʿɱ�ʾ��Һ�����Ե�ǿ�����絼��Խ����Խǿ��ͼ���ɱ�ʾ������ʹ�������Һ�е��백ˮ�����е絼�ʵı仯��ϵ |
�������ӷ���ʽ����ȷ���ǣ� ��
| A���������Ƽ���ˮ�� Na + 2H2O= Na+ + 2OH- + H2 �� |
B������ͨ��ˮ��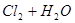   |
| C��FeBr2��Һ�м��������������ˮ 2Fe2++4Br-+3Cl2 =2Br2+6Cl-+2Fe3+ |
| D���Ȼ�����Һ�м��������ˮ A13++4NH3·H2O |
ij��Һ���ܺ���Cl����SO42����CO32����OH-��NH4+��Al3+��Fe3+��K+��ȡ����Һ100mL���������NaOH��Һ�����ȣ��õ�0.02mol���壬ͬʱ�������ɫ���������ˣ�ϴ�ӣ����գ��õ� 1.6g���壻��������Һ�м�����BaCl2��Һ���õ� 6.99g����������ij�����
���й���ԭ��Һ��˵����ȷ����
| A��ԭ��Һ�����ٴ���3������ |
| B��ԭ��Һ��һ�������ڵ������ǣ�Cl����CO32����OH- |
| C��ԭ��Һ�п��ܴ��ڵ������У�Cl����Al3+��K+ |
| D��ԭ��Һ��һ�����ڵ������ǣ�NH4+��Fe3+��SO42����Cl������c��Cl������0.2mol/L |
�������ۺ������ǣ� ��
| ѡ�� | ��ѧ��Ӧ�������ӷ���ʽ | ���� |
| A | Fe3O4��ϡ���ᷴӦ��2 Fe3O4+18H+=6Fe3++H2��+8H2O | ��ȷ |
| B | ��̼��þ�м���ϡ����: CO32��+2H+=CO2��+H2O | ����̼��þ��Ӧд��������ʽ |
| C | ���������Һ�м�������������Һ��Ba2++SO42��=BaSO4�� | ��ȷ |
| D | FeBr2��Һ������ʵ�����Cl2��Ӧ��2Fe2++2Br��+2Cl2="2" Fe3++4Cl��+Br2 | ����Fe2+��Br���Ļ�ѧ������֮��ӦΪ1:2 |
�������ӷ���ʽ��ȷ����
| A�������ʵ�����Ba(OH)2��KAl(SO4)2��12H2O��Һ��ϣ� 3Ba2��+6OH��+2Al3��+3SO42��=3BaSO4��+2Al(OH)3�� |
| B��Fe(OH)3��������Fe(OH)3+3H+=Fe3��+3H2O |
| C��H218O��Ͷ��Na2O2���壺2H218O+2O22��=4OH��+18O2�� |
| D��CuCl2��Һ�м���NaHS��Һ��Cu2��+2HS��+2H2O=Cu(OH)2��+2H2S�� |
����ˮ��Һ�д��������һ��������
| A��H����I-��NO3-��CO32- |
| B��Ag����Fe3����Cl-��SO42- |
| C��K����SO42����Cu2����NO3- |
| D��NH4����OH-��Cl-��HCO3- |