题目内容
将Na2O2逐渐加入到含有Al3+、Mg2+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入Na2O2的物质的量的关系如图所示则原溶液中Al3+、Mg2+、NH4+的物质的量分别为
| A.2 mol、3 mol、8 mol |
| B.3 mol、2 mol、8 mol |
| C.2 mol、3 mol、4 mol |
| D.3 mol、2 mol、4 mol |
C
解析试题分析:2Na2O2 + 2H2O =" 4NaOH" + O2↑ 分析图中拐点可以得出,当Na2O2的量为8mol时产生4mol氧气,Al3+、Mg2+、NH4+反应完全,到9mol时,氢氧化铝溶解完全,故有
n(Al3+)=n(Al(OH)3)=2mol
n(NH4+)=n(NH3)=8-4=4mol
n(Mg2+)=n(Mg(OH)2)=3mol
考点:考查图像的识别与计算有关问题。

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
下列各组离子可能大量共存的是
| A.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br- |
| B.遇pH试纸变红色的溶液:Fe2+、S2O32-、SO42-、Na+ |
| C.水电离出的c(H+) ?c(OH-) =10-28的溶液:Na+、S2-、NO3-、SO32- |
| D.能使KSCN显红色的溶液:Na+、NH4+、AlO2-、CO32- |
下列各组离子在指定溶液中能大量共存的是( )。
| A.无色溶液中:K+、Na+、MnO4-、SO42- |
| B.酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl- |
| C.加入Al能放出H2的溶液中:HCO3-、NO3-、Mg2+、Na+ |
| D.pH=11的溶液中:CO32-、Na+、AlO2-、NO3- |
下列微粒能够大量共存的是( )
| A.在pH=14的溶液中:HCO3-、Cl-、SO32-、K+ |
| B.在无色透明溶液中:Cu2+、K+、SO42-、Cl一 |
| C.在苯酚溶液中:Br-、Fe3+、NO3-、Cl- |
| D.在新制Cu(OH)2悬浊液中: CH3CHO、C2H5OH、SO42-、Na+ |
某溶液中可能含有OH—、CO32—、AlO2—、SiO32—、SO42—、HCO3—、Na+、Fe3+、Mg2+、
Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图像如下图所示。下列说法正确的是( )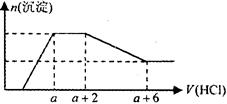
| A.原溶液中一定含有的阴离子是:OH—、SiO32—、AlO2—、CO32— |
| B.反应最后形成的溶液中的溶质为NaCl |
| C.原溶液中一定含有Na2SO4 |
| D.原溶液中含有CO32- 与AlO2-的物质的量之比为1∶2 |
下列反应的离子方程式正确的是( )
| A.澄清石灰水中滴加过量的小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| B.铵明矾[NH4Al(SO4)2·12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| C.H2O2溶液中滴加酸性KMnO4溶液:2 MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O |
D.尼泊金酸(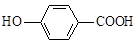 )与碳酸氢钠溶液反应: )与碳酸氢钠溶液反应: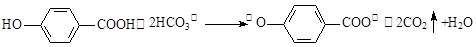 |
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液: 、、H+、 、、H+、 、 、 |
B.能使pH试纸呈红色的溶液:Na+、NH+4、 、 、 |
C.FeCl2溶液:K+、、Na+、、 、、 、、 |
D. =0.1 mol/L的溶液:Na+、K+、 =0.1 mol/L的溶液:Na+、K+、 、 、 |
下列示意图与对应的反应情况符合的是( )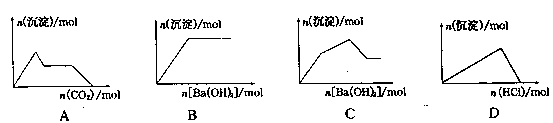
| A.向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量 |
| B.向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量 |
| C.向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量 |
| D.向NaAlO2溶液中逐滴加入盐酸至过量 |
将CO2气体缓缓地通入到含KOH、Ba(OH)2和KAlO2的混合溶液中直至过量,生成沉淀的物质的量与所通CO2的体积关系如图所示。下列关于整个反应进程中的各种描述不正确的是( )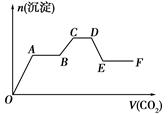
| A.O~A段反应的化学方程式是Ba(OH)2+CO2=BaCO3↓+H2O |
| B.B~C段反应的离子方程式是2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32- |
| C.A~B段与C~D段所发生的反应相同 |
| D.D~E段沉淀的减少是由于碳酸钡固体的消失所致 |