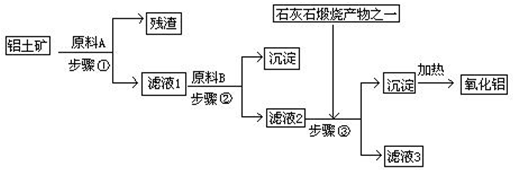
题目内容
14.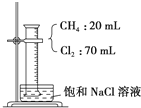 如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )
如图,在光照条件下,将盛有CH4和Cl2的量筒倒扣于盛有饱和食盐水的水槽中进行实验,对实验现象及产物分析中错误的是 ( )| A. | 混合气体的颜色变浅,量筒中液面上升 | |
| B. | 量筒内壁上出现的油状液滴,应只是三氯甲烷、四氯甲烷的混合物 | |
| C. | 已知HCl可降低NaCl的溶解度,故水槽中有固体物质析出 | |
| D. | 甲烷与氯气反应后的产物只有CCl4 |
分析 CH4和Cl2混合后在光照条件下发生取代反应:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl
CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl
CH2Cl2+Cl2$\stackrel{光照}{→}$CHCl3+HCl
CHCl3+Cl2$\stackrel{光照}{→}$CCl4+HCl
A、氯气是黄绿色气体;
B、CH3Cl是气体,CHCl3、CH2Cl2、CCl4是油状液体;
C、HCl溶于水后,能使NaCl的溶解平衡左移;
D、有机反应进行不彻底.
解答 解:CH4和Cl2混合后在光照条件下发生取代反应:CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl
CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl
CH2Cl2+Cl2$\stackrel{光照}{→}$CHCl3+HCl
CHCl3+Cl2$\stackrel{光照}{→}$CCl4+HCl
A、氯气是黄绿色气体,由于氯气被消耗,故混合气体颜色变浅;由于生成的HCl溶于水,而CHCl3、CH2Cl2、CCl4是油状液体故反应后气体体积变小,则液面上升,故A正确;
B、CHCl3、CH2Cl2、CCl4是油状液体,CH3Cl是气体但易溶于有机溶剂,故所得的油状液滴是CH3Cl、CH2Cl2、CHCl3和CCl4的混合物,故B错误;
C、HCl溶于水后,能使NaCl的溶解平衡左移,降低了NaCl的溶解度,故有固体析出,故C正确;
D、有机反应进行不彻底,故反应后产物中CH3Cl、CH2Cl2、CHCl3、CCl4和HCl均有,故D错误.
故选BD.
点评 本题考查了甲烷和氯气的取代反应,应注意的是有机反应进行不彻底,故反应后产物中CH3Cl、CH2Cl2、CHCl3、CCl4和HCl均有.

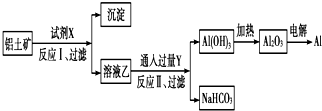
对上述流程中的判断不正确的是( )
| A. | 试剂X为NaOH溶液 | |
| B. | 反应Ⅱ中生成Al(OH)3的反应为:CO2+[Al(OH)4]-═Al(OH)3↓+HCO3- | |
| C. | 结合质子(H+)的能力由强到弱的顺序是OH->[Al(OH)4]->CO32- | |
| D. | 工业上还可采用热还原法冶炼Al |
(1)甲同学首先进行了实验1.
| 实验 1 | 实验步骤 | 实验现象 |
| ⅰ.取2mL 1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液3滴(1滴约为0.05mL,下同). | ⅰ.溶液呈棕黄色. | |
| ⅱ.向其中滴加2滴0.1mol•L-1 KSCN溶液. | ⅱ.溶液不显红色. |
②加入KSCN溶液的目的是检验溶液中是否大量存在Fe3+.
③甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,故改进实验方案,进行了实验2.
| 实验 2 | 实验步骤 | 实验现象 |
| ⅰ.取2mL 0.1mol•L-1 KI溶液,滴加0.1mol•L-1 FeCl3溶液3滴. | ⅰ.溶液呈棕黄色. | |
| ⅱ.向其中滴加2滴0.1mol•L-1 KSCN溶液. | ⅱ.溶液显红色. | |
| ⅲ.继续加入2mL CCl4,充分振荡、静置. | ⅲ.液体分层,上层红色消失,变为棕黄色,下层呈紫红色. |
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I- I3-.于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-.
①为验证假设,乙同学设计并完成了实验3.
| 实验3 | 实验步骤 | 实验现象 |
| ⅰ.取1mL实验2中棕黄色的上层清液,再加入2mL CCl4,振荡、静置. | ⅰ.液体分层,上层呈黄色,下层呈紫红色. | |
| ⅱ.取1mL饱和碘水,加入2mL CCl4,振荡、静置. | ⅱ.液体分层,上层为无色,下层呈紫红色. |
②甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-?I3-的存在.
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1mL水,振荡、静置;向试管2中加入1mL0.1mol•L-1KI溶液,振荡、静置.
两支试管中的现象分别为试管1中液体分层,上层为无色,下层呈紫红色,试管2中液体分层,上层呈黄色,下层呈紫红色(或紫红色变浅).
| A. | 容量瓶内壁沾有水滴没有烘干就进行配制 | |
| B. | 转移液体时有少量洒落 | |
| C. | 量取浓硫酸时仰视刻度线 | |
| D. | 定容摇匀后液面下降再加水 |
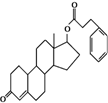
| A. | 含有四种官能团 | B. | 分子中所有碳原子不可能共平面 | ||
| C. | 是一种芳香族化合物 | D. | 含有一个酯基 |
| A. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| B. | 甲烷、乙烯和苯都能与酸性高锰酸钾溶液反应 | |
| C. | 乙酸乙酯和油脂在一定条件下都能水解 | |
| D. | 所有烷烃中都存在碳碳单键 |
| 温度 | X溶液的体积(mL) | X溶液的浓度(mol/L) | 水的体积(mL) | |
| A | 10℃ | 20 | 3 | 10 |
| B | 20℃ | 30 | 2 | 0 |
| C | 20℃ | 10 | 4 | 20 |
| D | 10℃ | 10 | 2 | 20 |
| A. | A | B. | B | C. | C | D. | D |
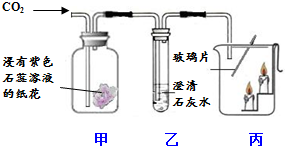 利用如图装置,验证CO2的性质.
利用如图装置,验证CO2的性质.