题目内容
【题目】将等质量混合的铜、锌和铁三种金属组成的混合物Wg加入到FeCl3和盐酸组合的混合液中,充分反应后,则下列说法正确的是
A. 若无固体剩余,则溶液中一定有的金属离子是Fe3+
B. 若无固体剩余,不可能有的离子是H+、Fe2+、Cu2+
C. 若剩余固体![]() g,则溶液中一定没有Fe3+、一定有H+
g,则溶液中一定没有Fe3+、一定有H+
D. 若剩余固体![]() g,则溶液中一定有Fe2+、Zn2+
g,则溶液中一定有Fe2+、Zn2+
【答案】D
【解析】(1)氯化铁能溶解铜、锌、铁,而盐酸只能溶解锌、铁;又因为三种金属性强弱顺序是Zn>Fe>Cu,溶液中离子氧化性强弱为:Fe3+>Cu2+>H+,所以若无固体剩余,铁离子过量或者恰好反应,氢离子没有参与反应,则溶液中的阳离子一定有Zn2+、Cu2+、Fe2+、H+;可能还含有Fe3+,故A、B错误;
(2)若剩余固体为w/3g,铜占总质量的1/3,即为w/3g;根据金属还原性:Zn>Fe>Cu,则剩余的固体一定是铜,溶液中的阳离子一定有Zn2+、Fe2+;由于铜过量,所以反应后的溶液中一定没有Fe3+,可能有H+,C错误,D正确。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2 . 某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验. 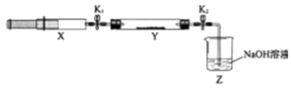
操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③ | ④ |