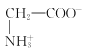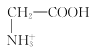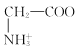题目内容
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料均为石墨)。

(1)图中a极要连接电源的________(填“正”或“负”)极,C口流出的物质是________。
(2)SO32-放电的电极反应式为__________。
【答案】负 硫酸或H2SO4 ![]()
【解析】
依据电解质溶液中阴阳离子的移动方向判断电极,阳离子移向阴极,a为阴极,b为阳极,![]() 在阳极失去电子变成
在阳极失去电子变成![]() ,可能伴有氢氧根离子放电生成氧气,所以C口流出的物质是H2SO4,阴极区放电离子为氢离子生成氢气,据此解答。
,可能伴有氢氧根离子放电生成氧气,所以C口流出的物质是H2SO4,阴极区放电离子为氢离子生成氢气,据此解答。
(1)由上述分析可知,a接电源负极;C口流出的物质是H2SO4,
故答案为:负;硫酸或H2SO4;
(2)![]() 发生氧化反应,放电的电极反应式为:
发生氧化反应,放电的电极反应式为:![]() ,
,
故答案为:![]() 。
。

练习册系列答案
相关题目