题目内容
15.镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的主要阳离子有( )| A. | Na+ | B. | Cu2+ | C. | Al3+ | D. | Mg2+ |
分析 铜与盐酸不反应,加过量盐酸时Mg、Al反应,过滤后向滤液中含镁离子、铝离子子,加入过量烧碱溶液,镁离子转化为沉淀,只有铝离子转化为偏铝酸钠存在于滤液中,以此来解答.
解答 解:镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,Cu不反应,发生Mg+2H+=H2↑+Mg2+、2Al+6H+=3H2↑+2Al3+,
过滤后向滤液中加入过量氢氧化钠溶液,发生H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++4OH-=AlO2-+2H2O,镁转化生成沉淀,铝元素存在于AlO2-中,
加入过量的NaOH溶液,滤液中存在的阳离子有Na+,
故选A.
点评 本题考查金属及化合物的综合应用,为高频考点,明确发生的离子反应是解本题关键,注意金属活动性及两性分析,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
5.如图体现了无催化剂参与反应过程的能量变化图.下列有关说法正确的是( )
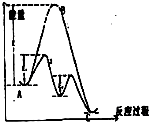

| A. | 使用正催化剂能够加快反应的速率,根本上是由于催化剂参与反应,并且同等程度地降低了正逆反应的活化能 | |
| B. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑△H>0,该反应过程可用该图象表示 | |
| C. | 使用催化剂不仅能加快反应速率,而且可以让不可能发生的反应发生,如利用催化技术处理汽车尾气:2CO+2NO═2CO2+N2 | |
| D. | 化学反应的本质是旧键断裂,新键形成,如图可知反应的能量变化由旧键断裂释放的能量和新键形成吸收的能量大小决定 |
6.对相对分子质量为128的烃的下列说法,正确的组合是( )
①可能是芳香烃 ②可能是苯的同系物③分子中不可能都是单键 ④分子中可能都是单键.
①可能是芳香烃 ②可能是苯的同系物③分子中不可能都是单键 ④分子中可能都是单键.
| A. | 只有①② | B. | 只有①③ | C. | 只有②③ | D. | 只有①④ |
3.对可逆反应平衡:A(g)+3B(g)?2C(g)△H<0,下列叙述错误的是( )
| A. | 升高温度,v(正)、v(逆)都增大,但v(正)增的更大 | |
| B. | 增大压强,v(正)、v(逆)都增大,但v(正)增的更大 | |
| C. | 增大A的浓度,v(正)会增大,但v(逆)会减小 | |
| D. | 采用适当催化剂(正),v(正)、v(逆)同时增大,而且增大的倍数相同 |
10.下列指定反应的离子方程式正确的是( )
| A. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-=Cu2++NO2↑+H2O | |
| B. | 在NaHSO4溶液中加Ba(OH)2至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| C. | 向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸:2OH-+CO32-+4H+=CO2↑+2H2O | |
| D. | 苏打溶液中加入稀HCl:CO32-+2H+=CO2↑+H2O |
20.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.工业上可利用煤的气化产物(水煤气)合成二甲醚.请回答下列问题:
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
若总反应平衡后,要提高CO的转化率,可以采取的措施是ce(填字母代号)
a.升温 b.加催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下平衡常数为400.此温度下,在密闭容器中加入CH3OH,某时刻测得各组分的浓度如表:
①比较此时正、逆反应速率的大小:v正> v逆 (填“>”、“<”或“=”).
②若加入CH3OH后,经10min达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(5)2H2+CO?CH3OH的催化剂为Cu2O,据研究,需要向反应体系中额外加入少量CO2,原因是:Cu2O+CO?2Cu+CO2(用化学方程式表示).
(1)煤的气化的主要化学反应方程式为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2.
(2)煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:Na2CO3+H2S═NaHCO3+NaHS.
(3)利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)?CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)?CH3OCH3(g)+CO2 (g)的△H=-246.4kJ•mol-1;
若总反应平衡后,要提高CO的转化率,可以采取的措施是ce(填字母代号)
a.升温 b.加催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(4)已知反应②2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下平衡常数为400.此温度下,在密闭容器中加入CH3OH,某时刻测得各组分的浓度如表:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.44 | 0.6 | 0.6 |
②若加入CH3OH后,经10min达到平衡,此时c(CH3OH)=0.04mol/L;该时间内反应速率v(CH3OH)=0.16 mol/(L•min).
(5)2H2+CO?CH3OH的催化剂为Cu2O,据研究,需要向反应体系中额外加入少量CO2,原因是:Cu2O+CO?2Cu+CO2(用化学方程式表示).
4.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤AlCl3⑥NaAlO2.
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤AlCl3⑥NaAlO2.
| A. | ②③④⑥ | B. | ②③④⑤ | C. | ①②③④⑤ | D. | ①②③④ |