题目内容
7.工业上常用铁质容器盛装冷浓酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是铁钉表面被钝化.
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中存在Fe2+,需要进行的实验操作、现象和结论是取少量溶液X于试管中,滴入几滴酸性高锰酸钾溶液,若高锰酸钾溶液的紫色褪去,则说明溶液中含有Fe2+.
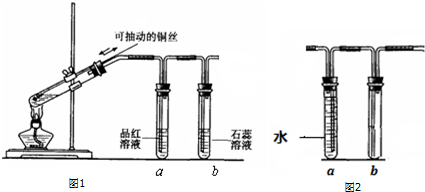
乙同学认为气体Y中除含有SO2、H2外,还可能含有CO2气体.为此设计了下列探究实验装置(图中夹持仪器省略).
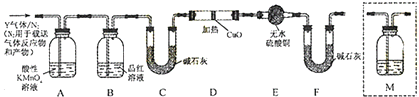
①认为气体Y中还含有CO2的理由是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O(用化学方程式表示).
②装置A中试剂的作用是除去混合气体中的SO2.
③为确认CO2的存在,需在装置中添加M于c(选填序号).
a.A之前 b.A-B间 c.B-C间 d.C-D间
④能说明气体Y中含有H2的实验现象是D中固体由黑变红,E中固体由白变蓝.
分析 (1)常温下,铁和浓硫酸发生钝化现象;
(2)溶液中同时存在铁离子和亚铁离子,需要用酸性高锰酸钾溶液检验亚铁离子;
①铁钉(碳素钢)中含有碳元素,碳与浓硫酸加热反应生成二氧化碳气体;
②混合气体中含有二氧化硫,酸性高锰酸钾溶液能够氧化二氧化硫,从而可除去二氧化硫;
③碳和浓硫酸反应生成二氧化碳,二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以应该在排除二氧化硫条件下将气体通入澄清石灰水中检验二氧化碳;
④氢气具有还原性,在加热条件下,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色.
解答 解:(1)常温下,铁和浓硫酸反应生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,所以将铁钉放入浓硫酸片刻无明显变化的原因是铁钉表面被钝化,
故答案为:铁钉表面被钝化;
(2)X中除Fe3+外还可能含有Fe2+,若要确认其中存在Fe2+,需要用酸性高锰酸钾溶液检验,方法为:取少量溶液X于试管中,滴入几滴酸性高锰酸钾溶液,若高锰酸钾溶液的紫色褪去,则说明溶液中含有Fe2+,
故答案为:取少量溶液X于试管中,滴入几滴酸性高锰酸钾溶液,若高锰酸钾溶液的紫色褪去,则说明溶液中含有Fe2+;
①铁钉(碳素钢)中含有C元素,碳与浓硫酸在加热条件下发生反应生成二氧化碳、二氧化硫和水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O;
②酸性高锰酸钾溶液能够氧化二氧化硫,会干扰后续检验,所以酸性高锰酸钾溶液的作用是除去混合气体中的SO2,
故答案为:除去混合气体中的SO2;
③碳和浓硫酸反应生成二氧化碳,二氧化硫和二氧化碳都能使澄清石灰水变浑浊,所以应该在排除二氧化硫条件下将气体通入澄清石灰水中检验二氧化碳,即:需在装置中添加M于B-C间,
故答案为:c;
④氢气具有还原性,在加热条件下,能将黑色的CuO还原为红色的Cu,且生成水,水能使无水硫酸铜变蓝色,所以如果Y中含有氢气,预计实验现象是:D中固体由黑变红,E中固体由白变蓝,
故答案为:D中固体由黑变红和E中固体由白变蓝.
点评 本题考查探究物质组成及性质实验方案设计与评价,为高频考点,题目难度中等,明确实验原理及每个装置可能发生的反应及其作用为解答关键,试题培养了学生的分析、理解能力及化学实验能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①用蒸馏的方法将海水淡化
②工业上可用金属铝与V2O5在常温下冶炼矾,铝作还原剂
③向溶液中滴入盐酸酸化的氯化钡溶液检验溶液中是否含有SO42-
④向含有Mg(OH)2和Ca(OH)2的浊液中加入足量MgCl2溶液,充分反应后过滤,除去Ca(OH)2.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
| A. | Na+ | B. | Cu2+ | C. | Al3+ | D. | Mg2+ |
| A. | 光导纤维的主要成分是二氧化硅,其主要原理是二氧化硅具有较好的导光性 | |
| B. | 盐卤点豆腐、明矾净水与胶体的性质有关 | |
| C. | 新型禽流感病毒H5N1型病毒致死率高,通过高温条件下可杀死H5N1型禽流感病毒 | |
| D. | 雾霾成为现代生活中主要的污染之一,其中PM2.5指标指的是分散质直径在2.5nm的微粒 |
| A. | 垃圾处理常用的方法是卫生填埋、焚烧、堆肥 | |
| B. | 将垃圾分类回收是垃圾处理的发展方向 | |
| C. | 填埋垃圾不需处理,只深埋即可 | |
| D. | 焚烧垃圾产生大量污染空气的物质,故不易采用此方法 |
| A. | 温度 | B. | 催化剂 | C. | 反应物浓度 | D. | 压强 |
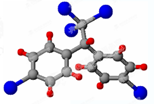 按要求完成下列问题:
按要求完成下列问题: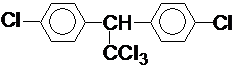 ;
;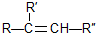 在一定条件下氧化可得产物
在一定条件下氧化可得产物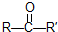 和
和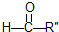 .某烃1mol在一定条件下氧化得到产物
.某烃1mol在一定条件下氧化得到产物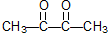 和OHCCH2CH2CHO各1mol.这种烃的结构简式是
和OHCCH2CH2CHO各1mol.这种烃的结构简式是 .
. 几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设
几位同学设计实验观察铜与浓硫酸的反应,检验生成的气体的性质.甲设