��Ŀ����
����Ŀ������100mL��Cu2+��Al3+��NH4+��H+��Cl������Һ�������Һ����μ���2.5mol��L��1NaOH��Һ������NaOH ��Һ�������mL����������������ʵ�����mol����ϵ����ͼ��ʾ��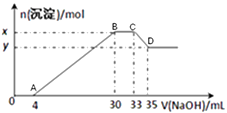
��1��B��ij�����Ļ�ѧʽΪ��
��2��ԭ��Һ��Cu2+�����ʵ���Ϊ �� ԭ��Һ��Cl�����ʵ���Ũ��Ϊ��
��3��ԭ��Һ��pH= �� x��y= ��
��4�������˵õ�D��ij���������������ˮϴ�ӳ������жϳ����Ƿ�ϴ�Ӹɾ��ķ�����
���𰸡�
��1��Al��OH��3��Cu��OH��2
��2��0.025mol,0.825mol/L
��3��1,0.005
��4��ȡ�������һ�ε�ϴ��Һ��һ�ྻ�Թ���,��ϡHNO3�ữ,�ټ���AgNO3��Һ,�ް�ɫ��������,˵�������Ѿ�ϴ�Ӹɾ���
����������100mL��Cu2+��Al3+��NH4+��H+��Cl-�����ӵ���Һ�У���μ���2.5molL-1��NaOH��Һ������4mLNaOH��Һʱû�г������ɣ�˵��H+�Ⱥ�NaOH��Ӧ������Һ�к���H+��c(H+)= ![]() =0.1mol/L�������μ�NaOH��Һ����������������30mLNaOH��Һ�����μ�NaOH��Һ�����������ʵ������䣬����Һ�к���NH4+����c(NH4+)=
=0.1mol/L�������μ�NaOH��Һ����������������30mLNaOH��Һ�����μ�NaOH��Һ�����������ʵ������䣬����Һ�к���NH4+����c(NH4+)= ![]() =0.075mol/L�������μ�NaOH�������ܽ⣬35mLNaOH�������ܽ⣬˵����Һ�к���Cu2+��Al3+������Al3++3OH-=Al(OH)3����Al(OH)3+OH-=AlO2-+2H2O֪������������������������ƫ�����������Ҫ�����������֮��Ϊ3��1����������������������ҪNaOH���=(35-33)mL��3=6mL��������������ͭ��ҪNaOH���=(30-4mL)-6mL=20mL����c(Cu2+)=
=0.075mol/L�������μ�NaOH�������ܽ⣬35mLNaOH�������ܽ⣬˵����Һ�к���Cu2+��Al3+������Al3++3OH-=Al(OH)3����Al(OH)3+OH-=AlO2-+2H2O֪������������������������ƫ�����������Ҫ�����������֮��Ϊ3��1����������������������ҪNaOH���=(35-33)mL��3=6mL��������������ͭ��ҪNaOH���=(30-4mL)-6mL=20mL����c(Cu2+)= ![]() =0.25mol/L��c(Al3+)=
=0.25mol/L��c(Al3+)= ![]() =0.05mol/L����Һ�д��ڵ���غ㣬���ݵ���غ��3c(Al3+)+2c(Cu2+)+c(NH4+)+c(H+)=c(Cl-)= [3��0.05+2��0.25+0.075+0.1]mol/L= 0.825mol/L��
=0.05mol/L����Һ�д��ڵ���غ㣬���ݵ���غ��3c(Al3+)+2c(Cu2+)+c(NH4+)+c(H+)=c(Cl-)= [3��0.05+2��0.25+0.075+0.1]mol/L= 0.825mol/L��
(1)��������������B��ij�����ΪAl(OH)3��Cu(OH)2��
���Դ��ǣ�Al(OH)3��Cu(OH)2��
(2)ԭ��Һ��Cu2+�����ʵ���n(Cu2+)=0.25mol/L��0.1L=0.025mol��ԭ��Һ��Cl�����ʵ���Ũ��c(Cl-)=[3��0.05+2��0.25+0.075+0.1]mol/L=0.825mol/L��
���Դ��ǣ�0.025mol��0.825mol/L��
(3)ԭ��Һ��c(H+)=0.1mol/L��pH=1��xΪAl(OH)3��Cu(OH)2�����ʵ�����yΪCu(OH)2�����ʵ��������ߵIJ�ΪAl(OH)3�����ʵ���=0.05mol/L��0.1L=0.005mol��
���Դ��ǣ�1��0.005��
(4)�����˵õ�D��ij������Һ�к��д��������ӣ������������ˮϴ�ӳ������жϳ����Ƿ�ϴ�Ӹɾ�ֻ��Ҫ�ж�ϴ��Һ���Ƿ���������Ӽ��ɣ�������ȡ�������һ�ε�ϴ��Һ��һ�ྻ�Թ��У���ϡHNO3�ữ���ټ���AgNO3��Һ���ް�ɫ�������֣�˵�������Ѿ�ϴ�Ӹɾ���
���Դ��ǣ�ȡ�������һ�ε�ϴ��Һ��һ�ྻ�Թ��У���ϡHNO3�ữ���ټ���AgNO3��Һ���ް�ɫ�������֣�˵�������Ѿ�ϴ�Ӹɾ���