题目内容
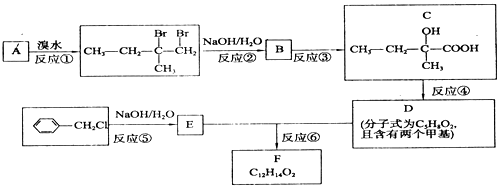
【题目】已知某烃A的产量是衡量一个国家石油化工水平的标志,能发生下列转化关系(部分反应物或生成物及反应条件已略去):
请回答下列问题:
(1)写出下列物质的结构简式:B , D;
(2)写出下列反应A→B的化学方程式 , 反应类型;
(3)写出下列反应C+E→F的化学方程式 , 反应类型 .
【答案】
(1)CH3CH2Cl;CH3CHO
(2)CH2=CH2+HCl ![]() CH3CH2Cl;加成反应
CH3CH2Cl;加成反应
(3)CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O;酯化反应
CH3COOCH2CH3+H2O;酯化反应
【解析】解:烃A的产量是衡量一个国家石油化工发展水平的标志,则A是乙烯,乙烯与HCl发生加成反应生成B为CH3CH2Cl,B发生水解反应生成C为CH3CH2OH,乙醇发生催化氧化生成D为CH3CHO,乙醛进一步发生氧化反应生成E为CH3COOH,乙酸与乙醇发生酯化反应生成F为CH3COOCH2CH3 , (1)由于上述分析可知,B的结构简式为CH3CH2Cl,D的结构简式为CH3CHO,所以答案是:CH3CH2Cl;CH3CHO;(2)乙烯与氯化氢发生加成反应生成CH3CH2Cl,方程式为CH2=CH2+HCl ![]() CH3CH2Cl,所以答案是:CH2=CH2+HCl
CH3CH2Cl,所以答案是:CH2=CH2+HCl ![]() CH3CH2Cl;加成反应;(3)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH
CH3CH2Cl;加成反应;(3)在浓硫酸作催化剂、加热条件下,乙醇和乙酸发生酯化反应生成乙酸乙酯,反应方程式为:CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O,所以答案是:CH3CH2OH+CH3COOH
CH3COOCH2CH3+H2O,所以答案是:CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O;酯化反应.
CH3COOCH2CH3+H2O;酯化反应.

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
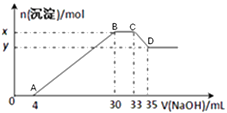
补充习题江苏系列答案【题目】表格中的各种情况,可以用如图的曲线表示的是( )
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 向温度和压强都相同的甲乙两容器中分别投入体积比1:3的N2、H2(N2+3H2═2NH3) | 氨气的物质的量 | 反应过程中保持恒温恒容 | 反 应过程中保持恒温恒压 |
D | 2molSO2和1molO2 , 在相同温度下 | SO3 的浓度 | 2个大气压 | 10个大气压 |
A.A
B.B
C.C
D.D
【题目】下列实验操作说法正确的是( )
选项 | 实验操作 | 现象与结论(或装置用途) |
A | 某溶液加入浓NaOH溶液加热,在试管口放一片湿润的红色石蕊试纸 | 试纸变蓝,说明NH3是碱 |
B |
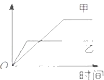
| 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
C | 2mL 2% CuSO4中加4~6滴2% NaOH溶液,振荡后加入0.5mL X溶液,加热煮沸 | 未出现砖红色沉淀,说明X不含有醛基 |
D |
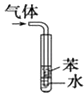
| 用于吸收HCl气体能防倒吸 |
A.A
B.B
C.C
D.D