题目内容
【题目】以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如图: 
回答下列问题:
(1)写H2O2的作用是并写出该步骤中发生的主要反应的离子方程式;
(2)如何检验中和反应后滤渣中阳离子已完全除尽?;
(3)写出工业制备金属铝的化学方程式 .
【答案】
(1)氧化亚铁离子为铁离子;2Fe2++H2O2+2H+═2Fe3++2H2O
(2)取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽
(3)2Al2O3 ![]() 4Al+3O2↑
4Al+3O2↑
【解析】解:Al(OH)3、H2SO4发生反应为2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O;工业(NH4)2SO4(含FeSO4)溶于水,然后向溶液中加入双氧水,双氧水具有氧化性、硫酸亚铁具有还原性,二者发生氧化还原反应生成铁离子和水,离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,将得到的溶液中加入氨水,调节溶液的pH,使铁离子转化为Fe(OH)3沉淀,然后过滤得到滤渣;将滤液加入硫酸铝溶液中,通过分离得到固体NH4Al(SO4)212H2O,加热固体NH4Al(SO4)212H2O,该物质分解生成M和含铝物质,(1)双氧水和亚铁离子发生氧化还原反应生成铁离子和水,过氧化氢作用是氧化亚铁离子生成铁离子,便于除去,离子反应方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,
所以答案是:氧化亚铁离子为铁离子,2Fe2++H2O2+2H+═2Fe3++2H2O;(2)中和液中的杂质离子是铁离子,铁离子用KSCN溶液检验,其检验方法为取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽,
所以答案是:取少量中和后的溶液,滴加KSCN溶液,若溶液不变红,则已完全除去;若溶液变红,则未除尽;(3)工业制备金属铝的化学方程式为:2Al2O3 ![]() 4Al+3O2↑,
4Al+3O2↑,
所以答案是:2Al2O3 ![]() 4Al+3O2↑;
4Al+3O2↑;

 名校课堂系列答案
名校课堂系列答案【题目】室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )
编号 | ① | ② | ③ | ④ |
气体M | H2S | NH3 | HI | NO |
气体N | SO2 | HCl | Cl2 | O2 |
![]()
A.③=④>①>②
B.③>④>①>②
C.④>③>②>①
D.④>③>①>②
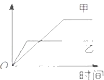
【题目】表格中的各种情况,可以用如图的曲线表示的是( )
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 向温度和压强都相同的甲乙两容器中分别投入体积比1:3的N2、H2(N2+3H2═2NH3) | 氨气的物质的量 | 反应过程中保持恒温恒容 | 反 应过程中保持恒温恒压 |
D | 2molSO2和1molO2 , 在相同温度下 | SO3 的浓度 | 2个大气压 | 10个大气压 |
A.A
B.B
C.C
D.D