题目内容
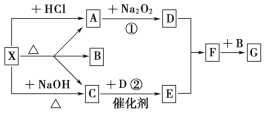
【题目】黑色固体物质A有如下图所示的转化关系。每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。
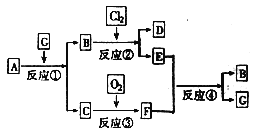
⑴写出B和C的化学式:B______________;C______________。
⑵写出反应④的离子方程式______________
【答案】FeSO4 H2S 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
【解析】
从框图中可以看出,反应②是解题的突破口。因为它的已知信息多,不仅有“D、E有共同的阳离子”,而且有Cl2这种具有强氧化性的特殊物质。
(1)由反应②知,B物质具有还原性;由反应④知,E物质具有氧化性,F气体具有还原性。综合分析反应②和④,可得出B中的阳离子具有还原性,从而得出其为亚铁盐。结合反应③,可得出F气体为SO2,C气体为H2S。再回到反应④,F为SO2,氧化产物必然为H2SO4,从而得出E为Fe2(SO4)3、B为FeSO4、G为H2SO4。由反应①,很容易得出A为FeS。由反应②,可得出D为FeCl3。答案为:B是FeSO4、C是H2S。
(2) 反应④的化学方程式为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4,离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+

练习册系列答案
相关题目