题目内容
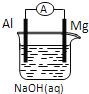
【题目】生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000-20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 |
|
|
|
键能 | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A. 反应中![]() 为吸热反应
为吸热反应
B. 过程![]() 放出能量
放出能量
C. 反应中![]() ,N2与F2的总能量小于NF3的总能量
,N2与F2的总能量小于NF3的总能量
D. NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
【答案】B
【解析】
化学键的断裂需要吸收能量,化学键的形成要放出能量,两个过程的总体热效应是反应热。若反应物键能之和小于生成物键能之和,则反应物的总能量高于生成物总能量,该反应为放热反应。
A项、反应物的键能之和为(941.7+3×154.8)kJmol-1=1406.1 kJmol-1,生成物键能之和为283.0×6KJmol-1=1698KJmol-1,反应物键能之和小于生成物键能之和,则反应物的总能量高于生成物总能量,该反应为放热反应,故A错误;
B项、N(g)+3F(g)→NF3(g)为化学键的形成过程,是一个放出能量的过程,故B正确;
C项、该反应为放热反应,反应物的总能量高于生成物总能量,则N2与F2的总能量大于NF3的总能量,故C错误;
D项、化学反应的实质就是旧键的断裂与新键的生成,如果没有化学键的断裂与生成,不可能发生化学反应,故D错误。
故选B。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】水溶性离子是大气颗粒物的主要成分,研究其化学组成对于治理大气污染其有重大意义,某地区大气颗粒物经采样与必要的预处理后得试样溶液。经离子色谱检验确定含有以下离子NH4+、Na+、Mg2+、Ca2+、Al3+、SO42-、NO3-、CO32-、Cl-。某同学对其再进行如下的实验:
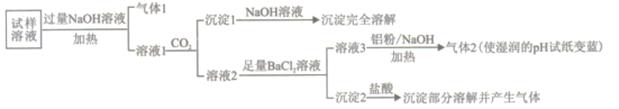
已知:在加热与强碱性条件下,铝单质可以将NO3-还原为氨气。
回答下列问题:
(1)“气体1“的电子式为_________。
(2)生成“沉淀1”的离子方程式为________。
(3)“沉定2”的成分是___________(填化学式)。
(4)“溶液3![]() 气体2”的离子方程式为_________。
气体2”的离子方程式为_________。
(5)根据上述实验可推断该地区大气颗粒物中__________含量较低(填离子符号)。
(6)已知大气颗粒物中各元素的行染主体如下表:
元素 | N | S | Na、Mg、Cl | Al | Ca |
污染主体 | 机动车尾气 | 燃煤污染 | 海盐离子 | 土壤扬尘 | 建筑粉尘 |
根据实验结果可判断该地区大气颗粒物污染主体有___________。
【题目】工业上利用粗ZnO(含FeO、CuO)制取金属锌的流程如下(部分步骤省略):
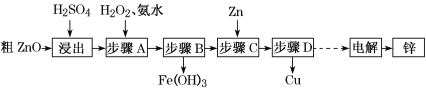
已知:几种离子形成氢氧化物沉淀时的pH如下表:
待沉淀的离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
开始沉淀时pH | 6.3 | 1.5 | 6.2 | 5.2 |
沉淀完全时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)酸浸粗氧化锌的过程中,为了加快酸浸速率,可采取的措施有______________ (写出一点即可)。
(2)步骤A的目的是将Fe2+氧化为Fe3+,并全部形成Fe(OH)3沉淀,为了暂不形成Cu(OH)2、Zn(OH)2,该步骤需控制溶液pH的范围是______________,该步骤中加入H2O2发生反应的离子方程式为_______________________________________。
(3)步骤D的操作名称为________________________________________________。
(4)由粗ZnO制取单质锌的另一种方法是将粗ZnO(含FeO、CuO)溶于NaOH溶液,ZnO全
部转化为Na2[Zn(OH)4]溶液,该反应的化学方程式为_________________________;然后将FeO、CuO过滤除去;再用惰性电极电解该滤液,阳极上逸出无色无味气体,阴极上析出锌,则阴极电极反应式为_____________________________________________。