题目内容
【题目】常温下,向20.00mL0.1000mol·L-1(NH4)2SO4溶液中逐滴加入0.2000mol·L-1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发)。下列说法正确的是( )
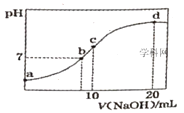
A.点a所示溶液中:c(NH4+)=2c(SO42-)>c(OH-)>c(H+)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-)
C.点c所示溶液中:c(SO42-)+c(H+)=c(NH3H2O)+c(OH-)
D.点d所示溶液中:c(SO42-)>c(NH3·H2O)>c(OH-)>c(NH4+)
【答案】C
【解析】
A.a点溶液中,铵根离子水解导致溶液呈酸性,即c(H+)>c(OH-),铵根离子水解程度较小,根据电荷守恒得c(H+)+c(NH4+)=2c(SO42-)+c(OH-),由于c(H+)>c(OH-),c(NH4+)<2 c(SO42-),结合物料守恒知c(NH4+)>c(SO42-),所以溶液中离子浓度大小顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-),故A错误;
B.b点溶液中,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH4+)>c(Na+),故B错误;
C.c点溶液中,溶液呈碱性,所以c(H+)<c(OH-),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42-)+c(OH-),根据物料守恒得,根据物料守恒得c(NH4+)+c(NH3H2O)=2c(SO42-)=2c(Na+),所以得c(SO42-)+c(H+)=c(NH3H2O )+c(OH-),故C正确;
D.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3H2O)>c(SO42-),故D错误;
答案选C。

 计算高手系列答案
计算高手系列答案【题目】氧化白藜芦醇W具有抗病毒等作用。下面是利用Heck反应合成W的一种方法:
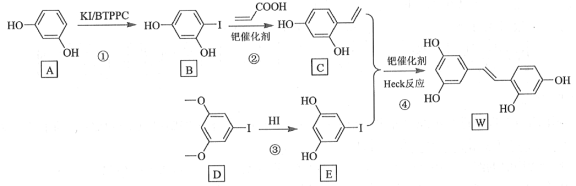
回答下列问题:
(1)A的化学名称为___________。
(2)![]() 中的官能团名称是___________。
中的官能团名称是___________。
(3)反应③的类型为___________,W的分子式为___________。
(4)不同条件对反应④产率的影响见下表:
实验 | 碱 | 溶剂 | 催化剂 | 产率/% |
1 | KOH | DMF | Pd(OAc)2 | 22.3 |
2 | K2CO3 | DMF | Pd(OAc)2 | 10.5 |
3 | Et3N | DMF | Pd(OAc)2 | 12.4 |
4 | 六氢吡啶 | DMF | Pd(OAc)2 | 31.2 |
5 | 六氢吡啶 | DMA | Pd(OAc)2 | 38.6 |
6 | 六氢吡啶 | NMP | Pd(OAc)2 | 24.5 |
上述实验探究了________和________对反应产率的影响。此外,还可以进一步探究________等对反应产率的影响。
(5)X为D的同分异构体,写出满足如下条件的X的结构简式________________。
①含有苯环;②有三种不同化学环境的氢,个数比为6∶2∶1;③1 mol的X与足量金属Na反应可生成2 g H2。
(6)利用Heck反应,由苯和溴乙烷为原料制备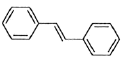 ,写出合成路线________________。(无机试剂任选)
,写出合成路线________________。(无机试剂任选)