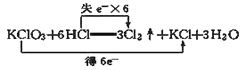
题目内容
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种粒子。其中N2、ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是

A. 该反应的氧化剂是ClO-
B. 消耗1mol还原剂,转移3mol电子
C. 氧化剂与还原剂的物质的量之比为2:3
D. 该离子方程式为3ClO-+2NH4+=2H++N2↑+3Cl-+3H2O
【答案】C
【解析】
根据物质的量变化、元素化合价升降确定反应物、生成物,配平离子方程式,并用氧化还原反应知识分析。
据图,ClO-物质的量减少,是反应物;N2物质的量增加,是生成物。因反应前后元素种类不变,得H2O、Cl-是生成物,NH4+是反应物。
A项:ClO-→Cl-,氯元素化合价降低,ClO-是氧化剂,A项正确;
B项:NH4+→N2,氮元素失电子,NH4+是还原剂,消耗1molNH4+时转移3mol电子,B项正确;
C项:据得失电子相等,ClO-和NH4+的消耗量之比为3:2,C项错误;
D项:据以上分析,可写出离子方程式3ClO-+2NH4+=2H++N2↑+3Cl-+3H2O,D项正确。
本题选D。

 名校课堂系列答案
名校课堂系列答案【题目】化合物A、B是中学常见的物质,其阴、阳离子只能从下表中选择。
阳离子 | K+、Na+、Fe2+、Ba2+、NH4+ 、Ca2+ |
阴离子 | OH–、NO3–、I–、HCO3–、AlO2–、HSO4– |
(1)若A、B的水溶液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝色的气体。
①B的化学式为________________,生成的气体电子式为___________
②A、B溶液混合加热反应的离子方程式___________________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。
①A的化学式为________________。
②经分析上述过程中溶液变黄的原因可能有两种:I._________________________、Ⅱ.____________________________________________。(用离子方程式表示)
③请用一简易方法证明上述溶液变黄的原因__________________________________ 。