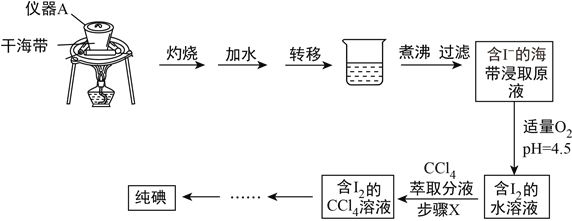
题目内容
【题目】燃烧产生的尾气中含有一定量的NO。科学家们设计了一种间接电处理法除去其中NO的装置,如下图所示,它可以将NO转化为NH4+。下列说法正确的是
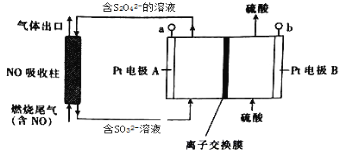
A. a连接电源的正极
B. Pt电极B上发生的电极反应为2H2O-4eˉ=O2↑+4H+
C. 当NO吸收柱中产生1mol SO32ˉ时,理论上处理的NO气体的体积为8.96L(标准状况)
D. 图中的离子交换膜应为阴离子交换膜
【答案】B
【解析】
根据图示,SO32ˉ在电极A上反应生成S2O42ˉ,反应中S元素的化合价由+4价变成+3价,化合价降低被还原,因此A为阴极,则B为阳极,在NO吸收柱中NO与S2O42ˉ反应生成氮气和SO32ˉ,据此分析解答。
A. 根据上述分析,A为阴极,B为阳极,a连接电源的负极,故A错误;
B. Pt电极B为阳极,发生氧化反应,电极反应为2H2O-4eˉ=O2↑+4H+,故B正确;
C. 当NO吸收柱中产生1mol SO32ˉ时,反应中消耗0.05molS2O42ˉ,转移1mol电子,根据得失电子守恒,处理的NO气体为0.5mol,标准状况下的体积为11.2L,故C错误;
D. 根据图示,阳极区硫酸的浓度基本不变,结合电极B的反应为2H2O-4eˉ=O2↑+4H+,生成的氢离子需要向阴极区运动,离子交换膜应为阳离子交换膜,故D错误;故选B。

【题目】某实验小组以 H2O2 分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2 溶液 | 无 |
② | 10 mL 5% H2O2 溶液 | 无 |
③ | 10 mL 5% H2O2 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
④ | 10 mL 5% H2O2 溶液+少量 HCl 溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
⑤ | 10 mL 5% H2O2 溶液+少量 NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3 溶液 |
(1)催化剂能加快化学反应速率的原因是_____。
(2)实验①和②的目的是_________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下 H2O2 稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____。
(3)写出实验③的化学反应方程式:_____。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是_____。