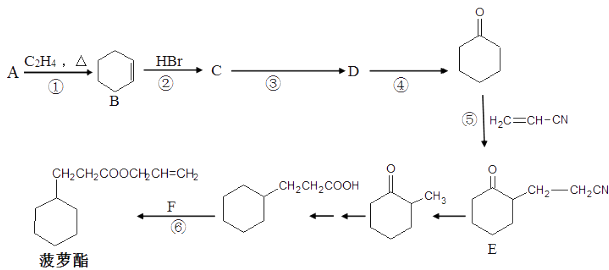
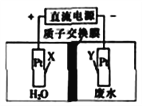
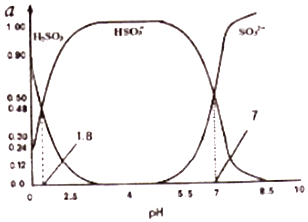
题目内容
【题目】下列对氧化还原反应的分析中合理的是 ( )
A.Mg变为MgO时化合价升高,因此,Mg在该反应中被氧化
B.非金属单质在反应中只作氧化剂
C.肯定有一种元素被氧化,另一种元素被还原
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
【答案】A
【解析】
A. Mg变为MgO时,镁元素化合价升高,因此Mg在该反应中被氧化,故A正确;
B. S和O2反应生成SO2,S作还原剂,O2作氧化剂,故B错误;
C. 氧化还原反应中,可以是同一元素既被氧化又被还原,故C错误;
D. 在化学反应中,得电子越多并不能说明得电子能力强,即氧化性不一定强,故D错误;
故选A。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】A、B、C、D、E为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
A | C | |
D | B | E |
(1)写出三种元素名称A________、B _______、C_______。
(2)B元素位于元素周期表中第______周期,_______族。
(3)比较B、D、E三种元素的最高价氧化物的水化物酸性最强的是(用化学式表示)______。
(4)C原子结构示意图为________________。