题目内容
【题目】处理工业酸性废水中NO3-的电解池工作原理如图所示,电解总反应为4NO3-+4H+![]() 2N2↑+5O2↑+2H2O。下列说法正确的是
2N2↑+5O2↑+2H2O。下列说法正确的是
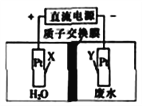
A. X电极上发生还原反应
B. Y电极上发生的电极反应为2NO3-+10e-+12H+==N2↑+6H2O
C. 电解池工作时,H+从质子交换膜右侧向左侧移动
D. 电解池工作时,电路中每通过2mol电子,生成15.68L气体
【答案】B
【解析】A. 根据图示,X电极为阳极,发生氧化反应,故A错误;B. Y电极为阴极,阴极上发生还原反应,电极反应为2NO3-+10e-+12H+==N2↑+6H2O,故B正确;C. 电解池工作时,阳离子从阳极向阳极移动,即H+从质子交换膜左侧向右侧移动,故C错误;D. 根据4NO3-+4H+![]() 2N2↑+5O2↑+2H2O反应中转移的电子为20,则电路中每通过2mol电子,生成0.7mol气体,由于为告知是否为标准状况,因此无法确定气体的体积是否为15.68L,故D错误;故选B。
2N2↑+5O2↑+2H2O反应中转移的电子为20,则电路中每通过2mol电子,生成0.7mol气体,由于为告知是否为标准状况,因此无法确定气体的体积是否为15.68L,故D错误;故选B。

【题目】一定温度下(T2>T1),在3个体积均为2.0L的恒容密闭容器中反应2NO(g)+Cl2(g)=2ClNO(g) (正反应放热)达到平衡,下列说法正确的是
容器 | 温度/ (℃) | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/ mol·L-1 | ||
c(NO) | c(Cl2) | C(ClNO).v | C(ClNO) | ||
Ⅰ | T1 | 0.20 | 0.10 | 0 | 0.04 |
Ⅱ | T2 | .020 | 0.10 | 0.20 | cl |
Ⅲ | T3 | 0 | 0 | 0.20 | C2 |
A. 达到平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1:2
B. 达到平衡时,容器Ⅲ中ClNO的转化率小于80%
C. 达到平衡时,容器Ⅱ中c(ClNO)/C(NO)比容器Ⅰ中的大
D. 若温度为T1,起始时向同体积恒容密闭容器中充入0.20molNO(g).、0.2mo1Cl2(g)和0.20molClNO(g),则该反应向正反应方向进行