题目内容
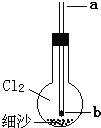
【题目】三氯氧磷(化学式:POCl3)无色透明的带刺激性臭味的液体,熔点1.25℃、沸点1.5℃,在潮湿空气中剧烈发烟,易与水反应。常用作半导体掺杂剂及光导纤维原料。工业上,“氯化水解法”生产三氯氧磷的方法一般是将三氯化磷加入反应釜中,通入氯气,同时滴加水,控制氯水比在3.94左右,并控制氯气和水的通入速率,其流程如下:
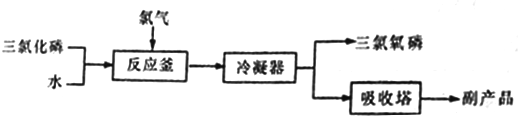
(1)在反应釜中将原料加热至105~109℃,“氯化水解法”生产三氯氧磷的化学方程式为___________。
(2)冷凝得到的粗三氯氧磷—般含有PCl3、H3PO3、PCl5和_________(填化学式)等杂质,进一步精制的方法是____________。
(3)已知H3PO3是—种易溶于水的二元弱酸。
①若将20 mL溶液与60 mL NaOH溶液等浓度混合并充分反应,化学方程式为______________。
②往废水中加入适量漂白粉并调节pH呈酸性,可将磷元素转化为磷酸钙沉淀回收,写出将H3PO3转化为磷酸钙的离子方程式:_____________________。
③经上述方法处理后的废水中c(PO43-) = 4×l0-7mol·L-1,溶液中c(Ca2+) =________mol·L-1。
(已知 Ksp[Ca3(PO4)2] = 2×10-29)
(4)工业上,还可以以三氯化磷为原料通过“氧气直接氧化法”制备三氯氧磷。从原理上看,与“氯化水解法”相比,该方法的优点是_______________________。(写出两点)
【答案】 PCl3+2H2O+Cl2![]() POCl3+2HCl H3PO4 蒸馏(或分馏) H3PO3+2NaOH═Na2HPO3+2H2O 2H3PO3+3Ca2-+2ClO-+6OH-═Ca3(PO4)2↓+2Cl-+6H2O 5×10-6 原子利用率高、无副产物,对环境污染小等合理答案均可
POCl3+2HCl H3PO4 蒸馏(或分馏) H3PO3+2NaOH═Na2HPO3+2H2O 2H3PO3+3Ca2-+2ClO-+6OH-═Ca3(PO4)2↓+2Cl-+6H2O 5×10-6 原子利用率高、无副产物,对环境污染小等合理答案均可
【解析】⑴“氯化水解法”生产三氯氧磷的反应物有PCl3、H2O、Cl2,生成物有POCl3,据原子守恒应该还有HCl生成,然后通过观察法将其配平,其化学方程式为:PCl3+2H2O+Cl2![]() POCl3+2HCl;⑵冷凝得到的粗三氯氧磷—般含有PCl3、H3PO3、PCl5和H3PO4等杂质,利用各成分的沸点不同,进一步精制的方法是蒸馏或分馏;(3)①H3PO3与NaOH反应生成Na2HPO3,其化学方程式为:H3PO3+2NaOH═Na2HPO3+2H2O;②漂白粉在酸性条件下将H3PO3转化为磷酸钙的离子方程式为:2H3PO3+3Ca2-+2ClO-+6OH-═Ca3(PO4)2↓+2Cl-+6H2O;③已知 Ksp[Ca3(PO4)2] = 2×10-29,处理后的废水中c(PO43-) = 4×l0-7mol·L-1,溶液中c(Ca2+)=
POCl3+2HCl;⑵冷凝得到的粗三氯氧磷—般含有PCl3、H3PO3、PCl5和H3PO4等杂质,利用各成分的沸点不同,进一步精制的方法是蒸馏或分馏;(3)①H3PO3与NaOH反应生成Na2HPO3,其化学方程式为:H3PO3+2NaOH═Na2HPO3+2H2O;②漂白粉在酸性条件下将H3PO3转化为磷酸钙的离子方程式为:2H3PO3+3Ca2-+2ClO-+6OH-═Ca3(PO4)2↓+2Cl-+6H2O;③已知 Ksp[Ca3(PO4)2] = 2×10-29,处理后的废水中c(PO43-) = 4×l0-7mol·L-1,溶液中c(Ca2+)=![]() mol·L-1=5×10-6mol·L-1;(4)工业上,还可以以三氯化磷为原料通过“氧气直接氧化法”制备三氯氧磷。从原理上看,与“氯化水解法”相比,该方法的优点是原子利用率高、无副产物,对环境污染小等。
mol·L-1=5×10-6mol·L-1;(4)工业上,还可以以三氯化磷为原料通过“氧气直接氧化法”制备三氯氧磷。从原理上看,与“氯化水解法”相比,该方法的优点是原子利用率高、无副产物,对环境污染小等。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:
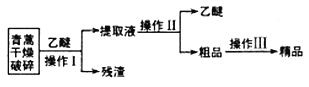
请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:
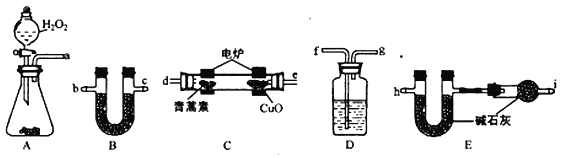
① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
【题目】a、b、c、d、e均为周期表前四周期元素,原子序数依次增大,相关信息如下表所示。
a | 原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
b | 基态原子的p轨道电子数比s轨道电子数少1 |
c | 在周期表所列元素中电负性最大 |
d | 位于周期表中第4纵行 |
e | 基态原子M层全充满,N层只有一个电子 |
请回答:
(1)d属于_____区的元素,其基态原子的价电子排布图为_____。
(2)b与其同周期相邻元素第一电离能由大到小的顺序为_____(用元素符号表示)。
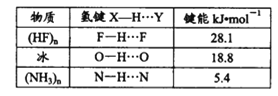
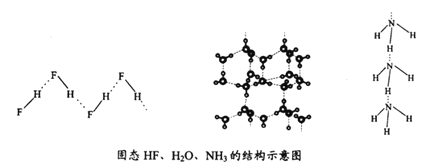
(3)c的氢化物水溶液中存在的氢键有_____种,任意画出一种:_____。
(4)a与其相邻同主族元素的最高价氧化物的熔点高低顺序为_____ (用化学式表示)。若将a元素最高价氧化物水化物对应的正盐酸根离子表示为A,则A的空间构型为_____;A的中心原子的轨道杂化类型为_____;与A互为等电子体的一种分子为_____ (填化学式)。
(5)向e的硫酸盐中加入氨水首先形成蓝色沉淀,继续滴加氨水沉淀溶解,得到深蓝色的透明溶液,试用离子方程式解释产生这一现象的原因:____________。