题目内容
6.下列气体溶于水时,发生了氧化还原反应的是( )| A. | Cl2溶于水 | B. | NH3溶于水 | C. | CO2溶于水 | D. | SO2溶于水 |
分析 氧化还原反应的特征是元素化合价的升降,如发生氧化还原反应,应存在元素化合价的变化,以此解答该题.
解答 解:A.Cl2和水反应生成HCl和HClO,Cl元素化合价发生变化,是氧化还原反应,故A正确;
B.NH3溶于水,元素化合价没有发生变化,不是氧化还原反应,故B错误;
C.CO2与水反应生成碳酸,元素化合价没有发生变化,不是氧化还原反应,故C错误;
D.SO2与水反应生成亚硫酸,元素化合价没有发生变化,不是氧化还原反应,故D错误.
故选A.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意从元素化合价的角度认识相关概念,判断相关物质的性质,本题注意与水反应的物质的性质,难度不大.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
10.铜有两种天然同位素,则${\;}_{29}^{63}$Cu+和${\;}_{29}^{65}$Cu具有相同的( )
| A. | 质量数 | B. | 中子数 | C. | 核电荷数 | D. | 能层和能级 |
11.下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | pH相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液:c(NH4+)大小顺序为①>②>③ | |
| B. | 0.2mol•L-1CH3COOH溶液和0.2mol•L-1CH3COONa溶液等体积混合:c(CH3COOH)+c(CH3COO-)=2c(Na+) | |
| C. | 0.1mol•L-1NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| D. | 0.1mol•L-1NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
14.过氧化钙(CaO2)是一种白色结晶体粉末,极微溶于水,不溶于醇类、乙醚等,加热至350℃左右开始分解放出氧气,与水缓慢反应生成H2O2.易于酸反应生成H2O2,过氧化钙可用于改善水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等,是一种重要化工试剂.
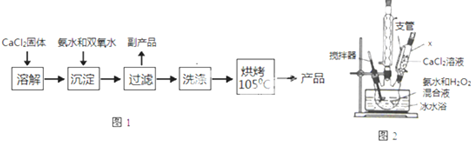
(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)仪器x的名称为恒压滴液漏斗(或恒压分液漏斗)
(2)用平衡移动原理解释加入氨水的作用是中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少双氧水受热分解、降低产物溶解度便于析出(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B
A.热水 B.冷水 C.乙醇 D.乙醚
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度90.00%
(6)测得CaO2纯度偏低的原因可能是AD
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.

(Ⅰ)CaO2的制备原理:CaCl2+H2O2+2NH3•H2O+6H2O═CaO2•8H2O↓+2NH4Cl实验步骤如图1,反应装置如图2所示,请回答下列问题:
(1)仪器x的名称为恒压滴液漏斗(或恒压分液漏斗)
(2)用平衡移动原理解释加入氨水的作用是中和反应生成的HCl,使CaCl2+H2O2?CaO2+2HCl向右进行.
(3)沉淀反应时常用冰水浴控制温度在0℃左右,其可能原因是减少双氧水受热分解、降低产物溶解度便于析出(写出两种)
(4)过滤后洗涤沉淀的试剂最好用B
A.热水 B.冷水 C.乙醇 D.乙醚
(Ⅱ)CaO2纯度检测,将一定量CaO2溶于稀硫酸,用标准KMnO4溶于滴定生成的H2O2(KMnO4反应后生成Mn2+)计算确定CaO2的含量.
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定所得数据如表所示,则CaO2样品的纯度90.00%
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
A.烘烤时间不足
B.在洁净干燥的酸式滴定管中未润洗即装标准液
C.滴定前尖嘴处有气泡.滴定后消失
D.配置KMnO4标准溶液定容时俯视容量瓶标线.
1.化学在生产、生活中有着广泛应用,下列说法中错误的是( )
| A. | 依次使用Na2CO3溶液和盐酸,可除去锅炉水垢中的CaSO4 | |
| B. | 草木灰溶液能够去除油污 | |
| C. | 低血糖症状出现时,吃馒头要比喝葡萄糖水见效快 | |
| D. | 若发生液氨泄漏,人应尽量往上风向处较低的位置转移 |
11.不能实现下列物质间直接转化的元素是( )单质→氧化物→氧化物→酸或碱.
| A. | 碳 | B. | 氮 | C. | 硫 | D. | 铝 |
18.反应3Cl2+8NH3═6NH4Cl+N2中,如果有0.6mol电子转移,则被氧化的氨的质量是( )
| A. | 3.4g | B. | 6.8g | C. | 10.2g | D. | 27.2g |
16.A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第3周期第一电离能最小的元素;D元素在第3周期中第一电离能最大.下列有关叙述错误的是( )
| A. | 四种元素A、B、C、D分别为O、Ca、Na、Ar | |
| B. | 元素A、B、C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等 | |
| C. | 元素A、C简单离子的半径大小关系为A<C | |
| D. | 元素B、C的单质与水都能剧烈反应 |
 .
.