题目内容
【题目】下列实验不能达到实验目的或者实验操作不正确的是
A. 定容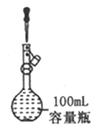
B. 比较硫、碳、硅三种元素
C. 处理尾气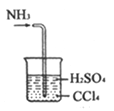
D. 测定黄铜(Cu、Zn素的非金属性强弱合金)中Zn的含量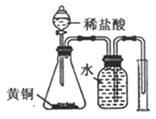
【答案】A
【解析】A.定容时,当液面距离刻度线下1~2cm处,改用胶头滴管滴加蒸馏水,图中液面距离刻度线远大于2cm,应该用玻璃棒引流注入蒸馏水,故A错误;B.若锥形瓶中生成气体,说明硫酸的酸性比碳酸强,烧杯中生成白色沉淀,说明碳酸的酸性比硅酸强,最高价氧化物对应水化物酸性越强,则对应元素的非金属性越强,因此比较硫、碳、硅非金属性强弱的实验方案合理,故B正确;C.氨气易溶于硫酸,难溶于四氯化碳,四氯化碳的密度比硫酸溶液大,导管口伸入下层液体可以防止倒吸,逸出的氨气被稀硫酸完全吸收生成铵盐,故C正确;D.锌是氢前金属,铜是氢后金属,前者与稀盐酸发生置换反应,生成的氢气难溶于水,水还能除去氢气中混有的氯化氢,排水量气法收集氢气,根据氢气的体积可以计算完全反应的锌的质量,进而可以求黄铜中锌的含量,故D正确;故选A。

 培优三好生系列答案
培优三好生系列答案【题目】二氧化碳的回收利用是环保领域研究热点。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。

(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比![]() 的关系如右图所示。
的关系如右图所示。

①平衡常数KA KB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。

(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0

上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)







