题目内容
【题目】钒和镍及其化合物是重要的催化剂和合金材料。
(1)基态V原子的价层电子排布式为________,其中排布时能量最高的电子所占据能级的原子轨道有________个仲展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
中,三种非金属原子的第一电离能由大到小的顺序为________(用元素符号表示);C原子的杂化轨道类型为_________。
(3)镍形成的[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子中N原子的价层电子对数目为______。与CN-互为等电子体的一种分子的化学式为__________。
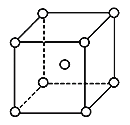
(4)La-Ni合金是重要的储氢材料,储氢后的晶胞如图所示。

①合金中,1个La原子周围距离最近且相等的La原子数目为_______。
②含有1mol Ni原子的合金中储存H2的物质的量为__________。
【答案】 3d34s2 5 O>C>H sp2、sp3 4 N2或CO 6 0.6mol
【解析】(1)V是23号元素,核外有23个电子,基态V原子的电子排布式为1s22s22p63s23p63d34s2,则价层电子排布式为3d34s2;能量最高的为3d轨道,有5个伸展方向;(2)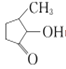 中,三种非金属原子分别为H、C、O,又是同一周期元素,元素的第一电离能随着原子序数的增大而增大,但第ⅱA族、第ⅴA族元素第一电离能大于其他相邻元素,同一主族从上到下,元素的第一电离能逐渐减小,所以H、C、O三种非金属元素原子的第一电离能由大到小的顺序为;又由
中,三种非金属原子分别为H、C、O,又是同一周期元素,元素的第一电离能随着原子序数的增大而增大,但第ⅱA族、第ⅴA族元素第一电离能大于其他相邻元素,同一主族从上到下,元素的第一电离能逐渐减小,所以H、C、O三种非金属元素原子的第一电离能由大到小的顺序为;又由 可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;
可以看出C原子分别形成单键和双键,则C原子的杂化轨道类型为sp3和sp2;
(3)NH3分子中N原子共用电子对数为3对,还有1对孤对电子对,所以NH3分子中N原子的价层电子排布对数目为4对;CN-中含有2个原子,且其价电子数是10,与CN-互为等电子体的一种分子为CO、N2等;
(4)①由晶胞可以看出1个La原子周围距离最近的La原子在顶点上,所以距离最近且相等的La原子数目为6;
②根据晶胞可以看出La原子个数为8×![]() =1,Ni原子个数为8×
=1,Ni原子个数为8×![]() +1=5,所以合金化学式为LaNi5,并且一个晶胞储存2×
+1=5,所以合金化学式为LaNi5,并且一个晶胞储存2×![]() +8×
+8×![]() =3个氢气分子,则1molNi原子的合金中储存H2的物质的量为
=3个氢气分子,则1molNi原子的合金中储存H2的物质的量为![]() mol=0.6mol。
mol=0.6mol。

【题目】芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。

(1)天冬酰胺所含元素中,________(填元素名称,下同)元素基态原子核外未成对电子数最多,第一电离能最大的是________。
(2)天冬酰胺中碳原子的杂化轨道类型为________,分子中σ键和π键数目之比为________。
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为________________________________________。
H2O、H2S、H2Se沸点由高到低的顺序为________________,酸性由强到弱的顺序为________________。
(4)写出铬的基态原子电子排布式:________________________________________。
(5)铬为体心立方晶体,晶胞结构如图,则该晶胞中含有______个铬原子。若铬的密度为ρg·cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为______cm。