题目内容
【题目】二氧化碳的回收利用是环保领域研究热点。
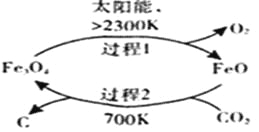
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2![]() CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比![]() 的关系如右图所示。
的关系如右图所示。
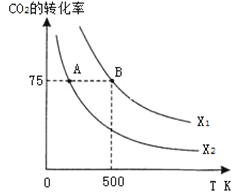
①平衡常数KA KB
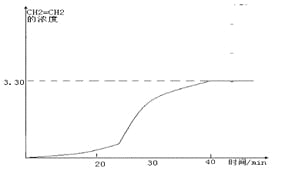
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0
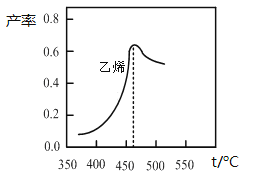
上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)
【答案】(1)![]() (见氧化亚铁才给分);
(见氧化亚铁才给分);
(2)a+c-1.5b kJ·mol-1 ;(3) ①> ② D ③
 (在20-30分钟内曲线突然变陡);
(在20-30分钟内曲线突然变陡);
(4)BD; (5)12
【解析】试题分析:(1)根据在太阳能的作用下,以CO2为原料制取炭黑的流程图可知,反应的原理为:![]() ,答案为:
,答案为:![]() ;(2)CH3OH(l)的标准燃烧热是指1molCH3OH(l)完全燃烧生成稳定氧化物,放出的热量,热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H,已知反应①CO2(g)+3H2(g)
;(2)CH3OH(l)的标准燃烧热是指1molCH3OH(l)完全燃烧生成稳定氧化物,放出的热量,热化学方程式为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H,已知反应①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H1=-a kJ·mol-1;②2H2(g)+O2(g)=2H2O(l) △H2=-b kJ·mol-1;③CH3OH(g)=CH3OH(l) △H3=-c kJ·mol-1,上述反应可以由反应①+③-3/2②得到,根据盖斯定律,甲醇的燃烧热△H= a+c-1.5b kJ·mol-1 ,答案为:a+c-1.5b kJ·mol-1 ;(3)温度升高化学平衡向吸热反应移动,该反应为放热反应,温度越低,平衡常数越大,所以有KA>KB,答案为:>;②从表格中可以看出氢气和二氧化碳的浓度先增大,后又减小,但最终的浓度是增大的,乙烯的浓度始终在增大,说明化学平衡横向移动,各物质的量浓度增大、平衡正向移动,说明是缩小容器的体积,答案为:D;③根据表格可以画出CH2=CH2的浓度随反应时间的变化曲线:
CH3OH(g)+H2O(l) △H1=-a kJ·mol-1;②2H2(g)+O2(g)=2H2O(l) △H2=-b kJ·mol-1;③CH3OH(g)=CH3OH(l) △H3=-c kJ·mol-1,上述反应可以由反应①+③-3/2②得到,根据盖斯定律,甲醇的燃烧热△H= a+c-1.5b kJ·mol-1 ,答案为:a+c-1.5b kJ·mol-1 ;(3)温度升高化学平衡向吸热反应移动,该反应为放热反应,温度越低,平衡常数越大,所以有KA>KB,答案为:>;②从表格中可以看出氢气和二氧化碳的浓度先增大,后又减小,但最终的浓度是增大的,乙烯的浓度始终在增大,说明化学平衡横向移动,各物质的量浓度增大、平衡正向移动,说明是缩小容器的体积,答案为:D;③根据表格可以画出CH2=CH2的浓度随反应时间的变化曲线: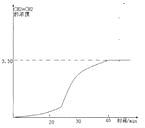 ,答案为:
,答案为: ;(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应:A.2CO2 (g)+ 6H2(g)
;(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应:A.2CO2 (g)+ 6H2(g)![]() CH2= CH2(g) +4H2O(g) △H< 0和 B.2CO2(g) + 6H2(g)
CH2= CH2(g) +4H2O(g) △H< 0和 B.2CO2(g) + 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H< 0,上右图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是:反应A是放热反应,温度升高,平衡常数减小,不可能是B,反应不变,反应的活化能不变,所以B反应的活化能不可能变,不可能是D,答案为:B D;(5)已知H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,那么反应CO32-+H2O
CH3OCH3(g)+3H2O(g) △H< 0,上右图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是:反应A是放热反应,温度升高,平衡常数减小,不可能是B,反应不变,反应的活化能不变,所以B反应的活化能不可能变,不可能是D,答案为:B D;(5)已知H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,那么反应CO32-+H2O![]() HCO3-+OH-的平衡常数K=KW/ Ka2=2×10-4,溶液中c(OH-)=
HCO3-+OH-的平衡常数K=KW/ Ka2=2×10-4,溶液中c(OH-)=![]() =1.0×10-2,溶液的pH为12,答案为:12.
=1.0×10-2,溶液的pH为12,答案为:12.