题目内容
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。

(1)科学家提出由CO2制取C的太阳能工艺如上图所示。
①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为________。
=6,则FexOy的化学式为________。
②“热分解系统”中每分解1molFexOy,转移电子的物质的量为________。
工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH3=________kJ·mol-1。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填字母)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的![]() 值变小
值变小
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如下图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=__________;KA、KB、KC三者之间的大小关系为____________。

(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中,c(NH![]() )________(填“>”、“<”或“=”)c(HCO
)________(填“>”、“<”或“=”)c(HCO![]() );反应NH
);反应NH![]() +HCO
+HCO![]() +H2O=NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
+H2O=NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
【答案】 Fe3O4 2mol -130.8 b 0.18mol·L-1·min-1 KA=KC>KB > 1.25×10-3
【解析】(1)①由示意图可知,重整系统中CO2和FeO反应生成FexOy和C,发生的反应中n(FeO)/
n(CO2) =6,根据Fe原子、O原子守恒可知x:y=6:(6+2)=3:4,故FexOy的化学式为Fe3O4;②“热分解系统”中分解的方程式为2Fe3O4=6FeO+O2↑,每分解1molFe3O4生成0.5mol氧气,转移电子的物质的量为0.5mol×4=2mol;已知:①CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1,②CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1,根据盖斯定律,①×2-②可得:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH3=-130.8kJ·mol-1。(2)①a.逆反应速率先增大后减小,可能是增大生成物浓度,平衡逆向移动,错误;b.氢气的转化率增大,平衡一定正向移动,正确;c.反应物的体积百分含量减小,可能是增大生成物浓度,平衡逆向移动,错误;d.容器中的n(CO2)/n(H2)变小,可能是减小二氧化碳物质的量,平衡逆向移动,错误;答案选b。②T1温度下,将6molCO2和12molH2充入2L的密闭容器中,由图象可知,5min后反应达到平衡状态时二氧化碳转化率为60%,则生成CH3OCH3为6mol×60%×1/2=1.8mol,所以平均反应速率v(CH3OCH3)=1.8mol÷(2L×
5min) =0.18molL-1min-1;③反应为放热反应,升高温度平衡向逆反应方向进行,转化率降低,因此T1<T2,而平衡常数只与温度有关系,则KA、KB、KC三者之间的大小关系为KA=KC>KB ;(3)根据盐类水解规律,已知NH3·H2O的电离平衡常数K=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11,所以碳酸氢根的水解程度更大,因此c(NH4+) >c(HCO3-);反应NH4++HCO3-+H2O=NH3·H2O+H2CO3的平衡常数K=c(NH3H2O)c(H2CO3) /
c(NH4+)c(HCO3)=c(H+)c(OH)/K(NH3H2O)K1 =![]() =1.25×10-3。
=1.25×10-3。

 名校课堂系列答案
名校课堂系列答案【题目】芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。

(1)天冬酰胺所含元素中,________(填元素名称,下同)元素基态原子核外未成对电子数最多,第一电离能最大的是________。
(2)天冬酰胺中碳原子的杂化轨道类型为________,分子中σ键和π键数目之比为________。
(3)O、S、Se为同主族元素,H2O、H2S和H2Se的参数对比见表。
化学式 | 键长/nm | 键角 |
H2O | 0.99 | 104.5° |
H2S | 1.34 | 92.3° |
H2Se | 1.47 | 91.0° |
H2S的键角大于H2Se的原因可能为________________________________________。
H2O、H2S、H2Se沸点由高到低的顺序为________________,酸性由强到弱的顺序为________________。
(4)写出铬的基态原子电子排布式:________________________________________。
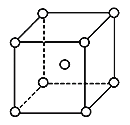
(5)铬为体心立方晶体,晶胞结构如图,则该晶胞中含有______个铬原子。若铬的密度为ρg·cm-3,相对原子质量为M,NA表示阿伏加德罗常数的值,则铬原子的半径为______cm。