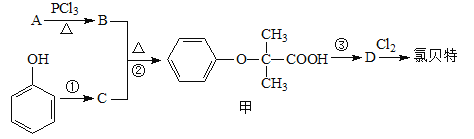
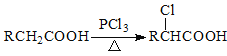
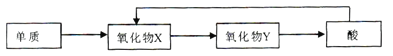
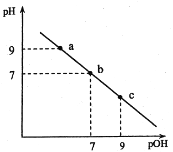
题目内容
【题目】已知热化学方程式:SO2(g)+1/2O2(g)![]() SO3(g)△H=―98.32kJ/mol,下列表述正确的是( )
SO3(g)△H=―98.32kJ/mol,下列表述正确的是( )
A、在容器中充入2molSO2和1molO2充分反应,最终放出的热量等于196.64kJ
B、在容器中当有2molSO2和1molO2发生反应时,放出的热量等于196.64kJ
C、在容器中当有4molSO2和2molO2发生反应时,反应SO2(g)+1/2O2(g)![]() SO3(g)的反应热为-393.28kJ/mol
SO3(g)的反应热为-393.28kJ/mol
D、在容器中当有4molSO2和2molO2发生反应时,反应SO2(g)+1/2O2(g)![]() SO3(g)的反应热为98.32kJ/mol
SO3(g)的反应热为98.32kJ/mol
【答案】B
【解析】
试题分析:A、该反应是可逆反应,不能完全反应, 2molSO2和1molO2充分反应,最终放出的热量小于196.64kJ ,错误;B、在容器中当有2molSO2和1molO2发生反应时,放出的热量等于196.64kJ,正确;反应热是固定的值,C、D错误;故选B。

练习册系列答案
相关题目