题目内容
【题目】A、B、C、D、E均为短周期元素,且原子序数依次增大;A的主族序数、周期数、原子序数均相同;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料;C是植物生长所需的主要元素之一;D和A可形成A2D和A2D2,A2D是最常见的溶剂;E原子次外层电子电子数等于其它层电子数之和。则
(1)E在周期表中的位置是______________,B、C、D、E与A形成的化合物中稳定性最强的是_______(该化学式)。
(2)C、D、E的离子半径由大至小顺序______________。
(3)写出B与由A、C、D组成的化合物的浓溶液在加热条件下的反应方程式:_________。
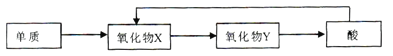
(4)A-E五种元素中,含同一元素的各类物质能实现下列转化的有______(填元素符号)。
(5)A2D2与FeSO4溶于稀硫酸,反应的离子方程式为_________。
(6)由A、B、C、D四种元素组成的化合物A,其原子个致比为7: 2 : l : 2,则A为(名称)__________。
【答案】 第3周期第ⅥA族 H2O S2->N3->O2- C+4HNO3(浓) ![]() CO2↑+4NO↑+2H2O N、S 2Fe2++H2O2+2H+=2Fe3++2H2O 醋酸铵。
CO2↑+4NO↑+2H2O N、S 2Fe2++H2O2+2H+=2Fe3++2H2O 醋酸铵。
【解析】根据元素在周期表中的位置、单质及其化合物的性质以及核外电子排布等首先判断出元素种类,然后结合元素周期律以及有关物质的性质解答。
短周期元素中主族序数、周期数、原子序数均相同的是H,则A为H元素;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料,非金属单质常用作电极的是碳,则B为C元素;D和A可形成化合物A2D和A2D2,且A2D是最常见的溶剂,则D为O元素;植物生长所需元素是N、P、K,又A、B、C、D、E均为短周期元素,且原子序数依次增大,则C为N元素;E原子次外层电子数等于其它层电子数之和,则E为第三周期元素S,则
(1)E为S元素,原子序数是16,在周期表中的位置是第三周期第ⅥA族;非金属性越强,对应氢化物的稳定性越强,C、N、O、S中非金属性O最强,稳定性最强的为H2O;(2)离子的电子层数越多,离子半径越大,核外电子排布时离子半径随原子序数的增大而减小,则离子半径大小顺序是S2->N3->O2-;(3)浓硝酸具有强氧化性,碳和浓硝酸反应的方程式为C+4HNO3(浓) ![]() CO2↑+4NO↑+2H2O;(4)根据转化关系可知,单质与氧气反应生成氧化物X,X与氧气反应生成氧化物Y,Y生成酸,酸可以生成X,这样的元素必须有变价,5种元素中满足条件的元素为:N、S;(5)双氧水具有氧化性,则H2O2与FeSO4溶于稀硫酸,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(6)由H、C、N、O四种元素组成的化合物A,其原子个致比为7: 2 : l : 2,则A为CH3COONH4,名称为硝酸铵。
CO2↑+4NO↑+2H2O;(4)根据转化关系可知,单质与氧气反应生成氧化物X,X与氧气反应生成氧化物Y,Y生成酸,酸可以生成X,这样的元素必须有变价,5种元素中满足条件的元素为:N、S;(5)双氧水具有氧化性,则H2O2与FeSO4溶于稀硫酸,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;(6)由H、C、N、O四种元素组成的化合物A,其原子个致比为7: 2 : l : 2,则A为CH3COONH4,名称为硝酸铵。