题目内容
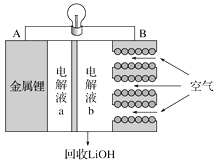
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在下图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
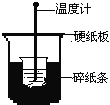
(1)从实验装置上看,图中尚缺少的一种玻璃用品是________。
(2)烧杯间填满碎纸条的作用是_____________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值将_______(填“偏大”、“偏小”或“无影响”)。
(4)实验中改用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比较,所放出的热量________(填“相等”或“不相等”),但中和热应_________(填“相等”或“不相等”),简述理由_________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________;用50mL0.50mol/LNaOH溶液进行上述实验,测得中和热的数值与57.3kJ/mol相比较会__________(均填“偏大”、“偏小”或“无影响”)。
【答案】环形玻璃搅拌器减少实验过程中热量损失偏小不相等相等因为中和热是指在稀溶液中,酸跟碱发生中和反应生成1molH2O所放出的能量,与酸碱用量无关偏小偏小
【解析】
(1)根据量热计的构造可知该装置的缺少仪器是环形玻璃搅拌器,故答案为:环形玻璃搅拌器;(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是:减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;(3)大烧杯上如不盖硬纸板,会有一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;(4)反应放出的热量和所用酸以及碱的量的多少有关,并若用60mL0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行上述实验,测得中和热数值相等,故答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关;(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,故答案为:偏小;用50mL0.50mol/LNaOH溶液进行上述实验,容易引起碱不足,测得中和热的数值与57.3kJ/mol相比较会偏小。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
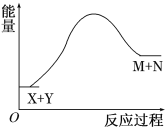
冲刺100分单元优化练考卷系列答案【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化如图所示。
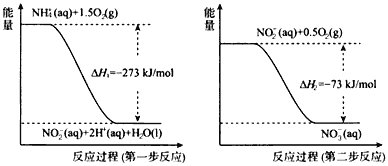
①第一步反应是____(填“放热”或“吸热”)反应。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是______。
(2)已知,H2(g)+Br2(l)=2HBr (g) △H=-72kJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其它相关数据如下表:
物质 | H2(g) | Br2(g) | HBr (g) |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
则表中a为_____。
(3)研究NO2、SO2 、CO等大气污染气体的处理方法具有重要的意义。
已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH= -196.6 kJ·mol-1
2SO3(g) ΔH= -196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH= -113.0 kJ·mol-1
2NO2(g) ΔH= -113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=____kJ·mol-1;
SO3(g)+NO(g)的ΔH=____kJ·mol-1;