题目内容
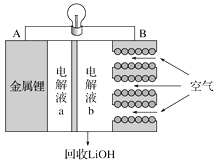
【题目】锂空气电池放电时的工作原理如下图所示。下列叙述正确的是( )
A. 放电时Li+由B极向A极移动
B. 电池放电反应为4Li+O2+2H2===4LiOH
C. B电极反应式为O2+4e-===2O2-
D. 电解液a可以为氯化锂溶液
【答案】B
【解析】
根据图像可知,在B极区生成LiOH,则放电时,锂离子、氢离子向B极移动;金属锂可与水反应,则电解液不能是水溶液;
A. 根据图像可知,放电时Li+由A极向B极移动,A错误;
B. 根据图像,锂与氢气与正极的氧气反应生成氢氧化锂,电池放电反应为4Li+O2+2H2=4LiOH,B正确;
C. B电极反应式为O2+4e-+2H++2Li+===2 LiOH,C错误;
D. 金属锂可与水反应,则电解液不能是水溶液,则电解液a可以为氯化锂溶液,错误;
答案为B

【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10(g)C8H8(g)+H2(g)△H=120kJ·mol-1某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
(1)当反应进行到20min时,该段时间内H2的平均反应速率是_____________。
(2)该温度下,该反应的化学平衡常数是_______________________。
(3)若保持其他条件不变,用0.40 molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是__________。此时,该合成反应是否达到了平衡状态?_______(填“是”或“否”)。
(4)工业上以高温水蒸气作为反应体系的稀释剂(不参与反应),C8H10(g)的平衡转化率与水蒸气的用量、体系的温度、压强的关系如图Ⅰ、图Ⅱ所示。

①由图Ⅰ可知,T1________T2(填“大于”、“小于”或“等于”)。
②由图Ⅱ可知,当其他条件不变时,水蒸气的用量越大,C8H10的平衡转化率将________(填“越大”、“越小”或“不变”),原因是______________________________________。
【题目】分离提纯下列物质时选用的试剂或方法不正确的是
分离提纯 | 试剂 | 方法 | |
A | 除去Cl2中的HCl | NaOH溶液 | 洗气 |
B | 提取溴水中的溴单质 | CCl4 | 萃取 |
C | 除去SiO2中的Fe2O3 | 稀盐酸 | 过滤 |
D | 除去乙醇中的水 | 无水CuSO4 | 蒸馏 |
A.AB.BC.CD.D